
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关.
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g)N2(g)+CO2(g)△H<0.
①下列情况能说明该反应达到平衡状态的是
A.2ν正(NO)=ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中,混合气体的密度保持不变
②在恒温、恒容条件下,加入2mol C(s)和2mol NO(g)达平衡后,再在绝热、恒容条件下,加入1mol NO重新达平衡后,N2的百分含量将(填“增大”、“减小”、“不变”).
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)N2O5(g)+O2(g).
若在容积为10L的密闭容器中进行该反应,起始时充入0.4molNO2、0.2mol O3 , 反应在不同条件下进行,反应体系总压强随时间的变化如图1所示.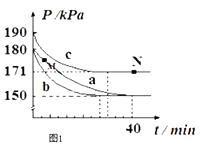
①实验a从开始至平衡时的反应速率v(O3)=;实验c中NO2的平衡转化率为 .
②与实验a相比,其他两组改变的实验条件分别是:b , c .
③M点的逆反应速率 v(逆)N点的正反应速率v(正) (填“>”、“<”或“=”).
④若在N点时,维持温度和压强不变,t1时再加入0.4molNO2、0.2mol O3 , 请在图中画出逆反应速率在t1后随时间t的变化曲线图2 . 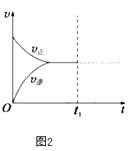
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏伽德罗常数,则下列说法正确的是( )
A.1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4﹣
B.已知反应:5Cl﹣+ClO3﹣+6H+=3Cl2+3H2O,每生成71g Cl2 , 则转移2NA个电子
C.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有氢原子数为4NA个
D.标准状况下,22.4LCCl4中含有NA个CCl4分子
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%浓硫酸配制0.1mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( )
A.未冷却就转移、定容
B.容量瓶内原有少量蒸馏水
C.定容时俯视刻度线观察液面
D.定容时加多了水再用吸管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意解答
(1)溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图1所示. 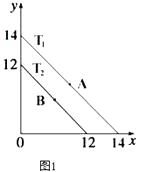
①若从A点到B点,可采取的措施为
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH﹣)将(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 则 T1℃时,在 0.5molL﹣1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍 .
④T2℃时,将某溶液(此溶液满足 lg[ ![]() ]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示: 
①m的取值为 .
②a点酸的浓度b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是 .
A.c(A﹣) B.n(H+)n(OH﹣) C. ![]() D.
D. ![]()
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10﹣10 , K1=4.3×10﹣7、K2=5.6×10﹣11 , 向NaCN溶液中通入少量CO2 , 所发生反应的离子方程式为:
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA
B.通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA
C.常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl﹣ 个数为0.4NA
D.标准状况下,11.2L He分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】关于晶体的叙述中,正确的是( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.0.1 mol/L FeCl3溶液:K+、Br﹣、H2O2
B.含大量NO3﹣的溶液:Fe2+、SO42﹣、H+
C.水电离产生的c(OH﹣)=10﹣13mol/L的溶液:Al3+、Na+、Cl﹣
D.![]() =1×1014的溶液:NH4+、CrO42﹣、ClO﹣
=1×1014的溶液:NH4+、CrO42﹣、ClO﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学-----我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该_______________用来灭火。
②经火焰灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)的元素是。_______________
③胃舒平(含有氢氧化铝)可治疗胃酸过多,其反应的离子反应方程式为:_______________。
④明矾能净水,其电离方程式是_______________。
(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(3)加热Al片的实验现象是_________________,原因是_____________。
【答案】 干沙子 K Al(OH)3 + 3H+ =Al3+ + 3H2O KAl(SO4)2 =K++ Al3+ + 2SO42- 2Na2O2 + 2CO2![]() 2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2 铝片融化,但是不脱落 氧化铝熔点高于铝,包在铝的外面。
【解析】(1)①钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,若金属钠等活泼金属着火时,应该用干沙子灭火;②含K元素的物质焰色反应为浅紫色(透过蓝色钴玻璃);③氢氧化铝治疗胃酸(盐酸)过多的离子反应方程式为:Al(OH)3+3H+=Al3++3H2O;④明矾是KAl(SO4)212H2O,溶于水后得KAl(SO4)2溶液,在溶液中能完全电离为铝离子、钾离子和硫酸根,故电离方程式为:KAl(SO4)2═K++Al3++2SO42﹣;(2)过氧化钠作潜艇供氧剂时发生的化学反应方程式是2Na2O2 + 2CO2![]() 2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
2Na2CO3+ O2;(3)加热Al片的实验现象是铝片融化,但是不脱落,原因是氧化铝熔点高于铝,包在铝的外面。
【题型】填空题
【结束】
20
【题目】将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
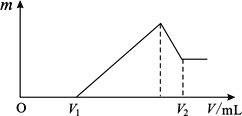
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com