
科目: 来源: 题型:
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组元素中,占细胞总量97%的一组是( )
A. C、H、O、N、P、S
B. C、Fe、K、Ca、B、Mg
C. N、P、S、K、Ca、Mg
D. Fe、Mn、B、Zn、Cu、Co
查看答案和解析>>
科目: 来源: 题型:
【题目】在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( ) 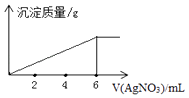
A.+1
B.+2
C.+3
D.+4
查看答案和解析>>
科目: 来源: 题型:
【题目】将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝克;
(2)当加入ml氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入ml氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀克.
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量MgO和Al2O3的混合物投入250mL 2molL﹣1的盐酸中,充分反应后无固体剩余,再向反应后的溶液中加入1molL﹣1NaOH溶液,要使镁、铝元素恰好完全沉淀下来,需加入NaOH溶液( )
A.450mL
B.500mL
C.400mL
D.不能确定
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
查看答案和解析>>
科目: 来源: 题型:
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解.
(1)SO3(g)分解的热化学方程式为
(2)工业上常用SO2制备Na2S2O3 , 向0.1mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为 .
(3)反应ii的△S0 (填“>”、“<”、“=”).
(4)对反应ii,可用V2O5作催化剂. 已知:SO2+V2O5SO3+V2O4K1、 ![]() O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
(5)L(L1、L2),X可分别代表压强或温度,如图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系. 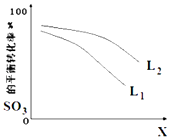
①X代表的物理量是;
②比较L1、L2的大小 .
(6)维持体系总压p恒定,在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应:2SO3(g)2SO2(g)+O2(g),已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=(用最简分数表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com