
科目: 来源: 题型:
【题目】如图表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,据图分析不正确的是( )

A. 若物质A是动、植物细胞中均含有的储能物质,则A是脂肪
B. 物质b是氨基酸,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为mn﹣18(n﹣2)
C. 物质c在人体细胞中共有5种,分子中的含氮碱基不同决定了c的种类不同
D. 物质d是性激素,d和胆固醇、维生素D都属于固醇类物质
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , 则此时V正>V逆
D.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
已知:(1)SiO32-和大量的H+会生成白色沉淀H2SiO3;
(2)H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)产生气体为在标准状况下测定,不考虑气体在水中的溶解。现取该溶液100 mL进行如下实验:
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是______________________。
(2)实验Ⅰ中生成沉淀的离子方程式为______________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ______ |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】15.8g KMnO4氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl,反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)该盐酸中HCl的物质的量浓度是______________________________。
(2)被氧化的HCl的物质的量为________________________。
(3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2008年5月,我国四川地区发生特大地震灾害,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。氯气(Cl2)是制备消毒剂的主要原料之一。工业上主要采用电解饱和食盐水的方法来制取Cl2。请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①Na2CO3溶液 ②Ba(OH)2溶液 ③稀盐酸。其中合理的加入顺序为___(填序号);
(2)实验室欲配制6.00 mol/L的食盐水90 mL,回答下列问题:
①需要纯净的NaCl___________________g。
②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的有_______(填字母),还缺少的仪器是__________。
③配制溶液时,一般可以分为以下几个步骤:计算称量溶解(________________________)转移(_____________________)定容(__________________________)装瓶。
④下列操作会使所配溶液的浓度偏小的是___________________。
A. 转移完溶液后未洗涤玻璃棒和烧杯 B. 容量瓶中原来有少量蒸馏水
C. 定容时,俯视刻度线 D. 称量氯化钠固体时左码右物
(3)在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为_____________________________;
(4)将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还原反应原理,写出此反应的化学方程式是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
已知:①溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
②氯水为氯气的水溶液。
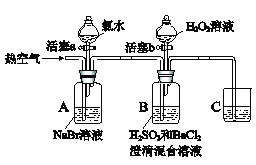
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为橙黄色 |
Ⅱ | 吹入热空气 | A中橙黄色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色 |
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________。
(2)实验操作II吹入热空气的目的是___________________________________。
(3)装置C的作用是_____________________________________。
(4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是____________。
(5)由操作I得出的结论是_____________,由操作III得出的结论是______________。
(6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
B. 氧化物:CO2、NO、SO2、H2O
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。则混合气体中CH4、C2H6、C3H8、的体积比不可能是: ( )
A. 2∶1∶2 B. 2∶3∶1 C. 1∶4∶1 D. 5∶3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com