
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 阳离子只有氧化性,阴离子只有还原性
B. 含氧酸可作氧化剂,而无氧酸不能
C. 在8NH3+3Cl2===N2+6NH4Cl反应中,氧化剂与还原剂分子个数之比是2:3
D. 已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-===2Fe2++Br2不易进行
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中,错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口。
C. 可用酒精萃取溴水中的溴。
D. 称量时,称量物放在纸上,置于托盘天平的左盘。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
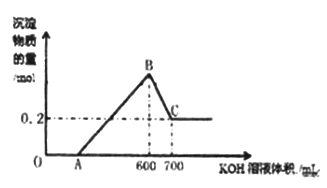
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目: 来源: 题型:
【题目】标出下列氧化还原反应过程中有关变化
(1)用单线桥标出电子的转移方向和数目 ,其中氧化剂是 .
NO+N O2+2NaOH═2NaN O2+H2O
(2)用双线桥标出化合价的变化,其中还原剂与氧化剂的物质的量比值是 .
2MnO4﹣+8H++5S O2═2Mn2++5SO42﹣+4H2O.
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置.
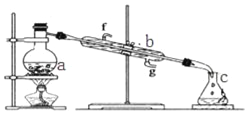
(1)写出下列仪器的名称:a.__ b.__;
(2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母);
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__.
(4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸.
II.(5)现需配制0.1molL﹣1NaOH溶液480mL,根据此,回答下列问题:
①配制氢氧化钠溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和__.
②实验时需要称量氢氧化钠__g;
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)__.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④配制0.1molL﹣1NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有__(填写字母).
A.称量时用了生锈的砝码 B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液 E.定容时仰视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究氮、磷等单质及其化合物的反应有重要意义.
(1)试判断用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下能否自发进行(填“能”或“否”).已知:在298K、100kPa下该反应的△H=﹣113.0kJmol﹣1 , △S=﹣145.3Jmol﹣1K﹣1 .
(2)25℃下,将a molL﹣1的氨水与0.005molL﹣1的硫酸等体积混合,反应平衡时溶液中c(NH4+)=2c(SO42﹣),用含a的代数式表示NH3H2O的电离常数Kb= .
(3)25℃时,Ksp(BaSO4)=1.1×10﹣10 , Ksp(BaCO3)=2.6×10﹣9 , 现将BaCl2溶液滴入浓度均为0.01molL﹣1的Na2SO4和Na2CO3的混合溶液中,当两种沉淀共存时,溶液中c (CO32﹣):c(SO42﹣)=(不考虑CO32﹣的水解)
(4)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式: .
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH﹣)﹣c(H3PO2)= . 该温度下将pH=a的盐酸Vaml与pH=b的氢氧化钠Vbml混合后溶液呈中性,且a+b=10,则Va:Vb= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com