
科目: 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A. 纯碱、烧碱均属于碱B. 凡能电离出H+的化合物均属于酸
C. 盐类物质一定含有金属阳离子D. CuSO4·5H2O属于纯净物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A.干冰升华要吸收大量的热,属于化学反应中的吸热反应
B.人们用氧炔焰焊接或切割金属,主要是利用了乙炔燃烧时所放出的热量
C.木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应
D.NaOH固体溶于水后温度升高,说明NaOH的溶解只有放热过程
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A,B,C,D,E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A,B,C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为产生温室效应的主要气体.B,C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B,C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A,B,C,D,E用所对应的元素符号表示)
(1)A,B,C的第一电离能由小到大的顺序为 .
(2)B的氢化物分子的立体构型是 , 其中心原子采取杂化.
(3)写出化合物AC2的电子式;一种由B,C组成的化合物与AC2互为等电子体,其化学式为 .
(4)E的核外电子排布式是 , ECl3形成的配合物的化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角之一。下列关于硅及其化合物性质的说法,不正确的是
A. 硅的非金属性比硫弱 B. 硅酸钠可溶于水
C. SiO2与氢氟酸能反应 D. 硅原子易失去或得到电子
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末可能是Fe2O3、Cu2O或二者混合物.探究过程如下:[查资料]Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4 , 在空气中加热生成CuO.
[提出假设]假设1:红色粉末是Fe2O3 . 假设2:红色粉末是Cu2O.假设3:两者混合物.
(1)[设计探究实验]取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.设1成立,则实验现象是 .
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗? , 简述你的理由(不需写出反应的方程式) .
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是 .
(4)[探究延伸]经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
(1)[提出猜想]Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有二种;(填分子式)
(2)Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.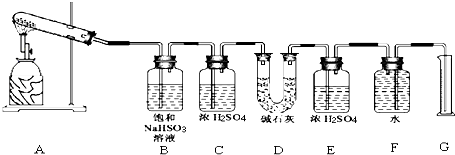
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
①若实验结束时,G中量筒没有收集到水,则证明猜想正确.(填Ⅰ或Ⅱ或Ⅲ)
②若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由: .
③该实验设计中,容易给测定带来较大误差的因素有 .
(写出一种即可)
④经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
实验小组 | 称取CaSO4 | 装置D增加 | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
一 | 4.08 | 2.56 | 224 |
二 | 5.44 | 2.56 | 448 |
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组: .
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
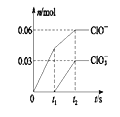
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com