
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 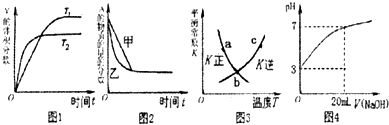
A.图1表示可逆反应“2X(g)Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构. 
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
依据表数据列式计算该NaOH溶液的物质的量浓度(保留两位有效数字)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
依据表数据列式计算该NaOH溶液的物质的量浓度(保留两位有效数字)
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
(1)写出平衡常数K的表达式 , 如果降低温度,该反应K值 , 化学反应速率 , N2的转化率(填“增大”、“减小”或“不变”).
(2)在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: 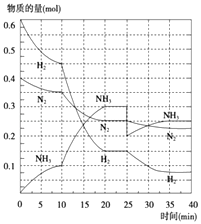
①10min内以NH3表示的平均反应速率: .
②在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次达到平衡的时间为: , 第2次达到平衡的时间为:;
④在反应进行至25min时,曲线发生变化的原因
A.缩小容器体积 B.降低温度 C.分离了部分NH3
达第二次平衡时,新平衡的平衡常数K2K1 ,
(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Fe2 (SO4)3、ZnSO4、Na2SO4三种溶液分别与足量BaCl2溶液反应。若生成BaSO4沉淀质量比为1︰1︰1,则三种硫酸盐溶液的物质的量比为( )
A. 1:6:9B. 1:2:3C. 1:3:3D. 1:3:6
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:

①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com