
科目: 来源: 题型:
【题目】在一定温度下,将X和Y 各0.16mol充入10L 恒容密闭容器中,发生反应:2X(g)+Y(s)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表下列说法正确的是( )
t/s | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.10 | 0.09 | 0.09 |
A.反应前2s的平均速率v(Z)=2.0×10﹣3 mol/(Ls)
B.其他条件不变,加入一定量的Y,反应速率一定加快
C.反应进行4s时,X的转化率75%
D.反应达到平衡时,X的物质的量浓度为0.02molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过如图方法合成: 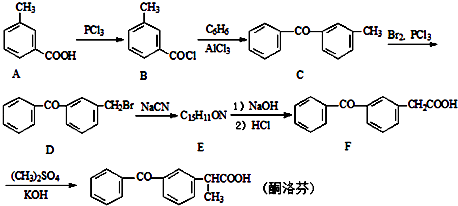
(1)酮洛芬中含氧官能团的名称为和 .
(2)化合物E的结构简式为;由C→D的反应类型是 .
(3)写出B→C的反应方程式 .
(4)写出同时满足下列条件的A的一种同分异构体的结构简式 .
Ⅰ、能发生银镜反应
Ⅱ、与FeCl3发生显色反应
Ⅲ、分子中含有5种不同化学环境的氢
(5)请写出以甲苯和乙醇为原料制备化合物 ![]() 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: 
(1)金属M为 , 操作1为 .
(2)加入H2O2的作用是(用离子方程式表示) , 加入氨水的作用是 .
(3)充分焙烧的化学方程式为 .
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是 , 90℃时Ksp(Li2CO3)的值为 .
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL﹣1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42﹣)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊试液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中 ![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g)+2B(g)C(g)
反应过程中测定的部分数据见表:下列说法正确的是( )
反应时间/min | n(A)/mol | n(B)/mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
A.前10min内反应的平均速率为v(C)=0.050molL﹣1min﹣1
B.保持其他条件不变,起始时向容器中充入0.50molA气体和0.60molB气体,到达平衡时,n(C)<0.25mol
C.若密闭容器体积不变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能在指定溶液中,大量共存的是( )
A.含大量SO2的溶液中:NH4+、F﹣、HCO3﹣、ClO﹣
B.能使淀粉碘化钾试纸变蓝的溶液:Cl﹣、Na+、S2﹣、NH4+
C.![]() =10﹣13mol/L的溶液中:Al3+、Fe3+、NO3﹣、ClO4﹣
=10﹣13mol/L的溶液中:Al3+、Fe3+、NO3﹣、ClO4﹣
D.滴入KSCN溶液显红色的溶液中:NO3+、Na+、AlO2﹣、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com