
科目: 来源: 题型:
【题目】Ⅰ.如图所示为常见玻璃仪器的部分结构:
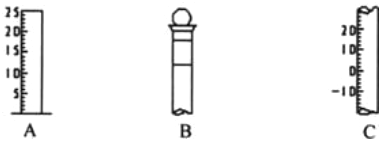
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 上标记有________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)仪器 B 使用前必须__________________。
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
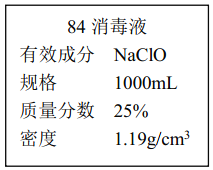
(1)该“84 消毒液”的物质的量浓度约为________mol·L-1。(保留两位有效数字)
(2)某同学取 100 mL 该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c(Na+)=________ mol·L-1。
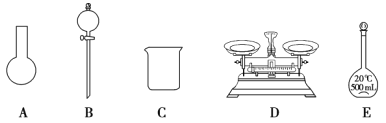
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是两种致癌物质的结构简式,以下的描述正确的是( ) 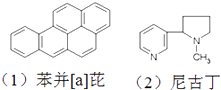
A.(1)的分子式是 C20H12
B.(2)的分子式是 C10H13N2
C.它们都属于烃
D.(1)的分子是由5个苯的结构单元并合而成,所以它是苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热的测定实验(如图). 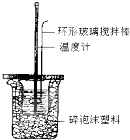
①量取反应物时,取50mL0.50molL﹣1的盐酸,还应加入的试剂是(填序号).
A.50mL0.50molL﹣1NaOH溶液
B.50mL0.55molL﹣1NaOH溶液
C.1.0gNaOH固体
②在该实验过程中,该同学需要测定的实验数据有(填序号).
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL0.5molL﹣1醋酸溶液代替上述盐酸测定中和热,所得数据 . (填“偏大”或“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)今有铁片、铜片, FeCl2 溶液 、 FeCl3 溶液、 CuSO4溶液, 设计实验证明 Fe3+的氧化性比 Cu2+强, 写出相应的化学方程式______________;
(2)野外作业中用于焊接铁轨,该反应的化学方程式为______________;
(3)将一个铝制易拉罐充满 CO2气体,然后往罐内注入足量的 NaOH 溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起。 试用离子方程式解释易拉罐又重新鼓起的原因______________;
(4)用小苏打片(NaHCO3)治疗胃酸(盐酸)过多的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
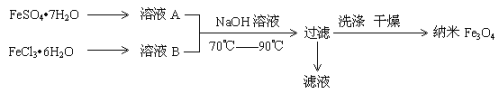
下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】2019 年 12 月 27 日晚,长征五号运载火箭“胖五”在海南文昌航天发射场成功将实践二十号卫星送入预定轨道。下列有关说法正确的是
A.胖五”利用液氧和煤油为燃料,煤油为纯净物
B.火箭燃料燃烧时将化学能转化为热能
C.火箭箭体采用铝合金是为了美观耐用
D.卫星计算机芯片使用高纯度的二氧化硅
查看答案和解析>>
科目: 来源: 题型:
【题目】新型冠状病毒引发的肺炎疫情是2020年最大的公共卫生事件。下列关于新冠肺炎及其防治措施正确的是( )
A.新冠病毒害怕酒精是因为酒精能使蛋白质失去生理活性
B.聚丙烯是制造口罩的原料,聚丙烯能使酸性高锰酸钾溶液褪色
C.双氧水不能用于家庭消毒以预防新冠肺炎
D.抗病毒疫苗可以在高温下贮运
查看答案和解析>>
科目: 来源: 题型:
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: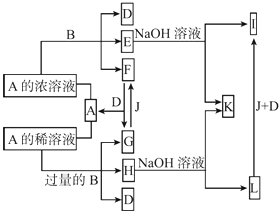
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com