
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
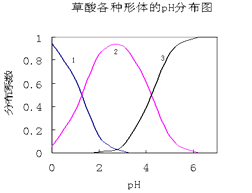
(1)图中曲线1表示________________的分布系数变化。
(2)现有物质的量浓度均为0.1mol/L的下列溶液:
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
已知NaHC2O4溶液显酸性。
①NH4HC2O4显_____性(填“酸”、“碱”或“中”)
②Na2C2O4溶液中,![]() ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
③常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_______性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
④五种溶液中c(H2C2O4)由大到小排列的顺序是 ________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. Na2SO4既属于钠盐又属于硫酸盐
B. CO2水溶液能导电,所以CO2是电解质
C. 氯化钠溶液在电流作用下电离成钠离子和氯离子
D. 向硝酸溶液中加入少量氢氧化钠固体,溶液的导电能力显著降低
查看答案和解析>>
科目: 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 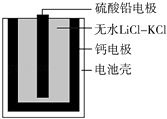
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.醋酸和足量的氢氧化钠溶液反应:H++OH﹣═H2O
B.溴化亚铁溶液中通入足量的氯气:2 Fe2++4 Br﹣+3 Cl2═2 Fe3++2 Br2+6 Cl﹣
C.用小苏打治疗胃酸过多:HCO ![]() +H+═CO2↑+H2O
+H+═CO2↑+H2O
D.碳酸氢铵稀溶液中加入过量的石灰水:Ca2++HCO ![]() +2 OH﹣+NH
+2 OH﹣+NH ![]() ═CaCO3↓+NH3?H2O+H2O
═CaCO3↓+NH3?H2O+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 . 对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 molL﹣1s﹣1
B.分别用B,C,D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0.3 molL﹣1min﹣1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:

(1)试写出铁屑转化为Fe(OH)3的离子反应方程式:______________________________________。
(2)判断碘是否已完全反应的实验方法是______________________________________________。
(3)分离出NaI样品需在低温无氧环境中进行,其目的是__________________________________。
(4)测定产品中NaI含量的方法是:______________
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有______________________________。
②上述样品中NaI的质量分数为__________________________。
(5)已知Ksp(AgI)=1.5×10-16,将AgNO3和NaI的溶液混合,假设混合液中AgNO3的浓度为0.01 mol/L,则开始生成AgI沉淀时,混合液中c( I- )=____________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O ![]() 和CrO
和CrO ![]() ,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法
该法的工艺流程为④③②①
CrO ![]()
![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色.
(2)能说明第①步反应达平衡状态的是 . a.Cr2O ![]() 和CrO42的浓度相同
和CrO42的浓度相同
b.2v(Cr2O ![]() )=v(CrO42)
)=v(CrO42)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72﹣离子,需要mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5 mol/L,溶液的pH应调至 .
方法2:电解法
该法用Fe做电极电解含 Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为 .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) , 溶液中同时生成的沉淀还有 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( ) 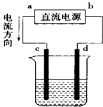
A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中错误的是
A. 做“氢气还原氧化铜”实验时,应先通氢气再加热
B. 蒸馏时烧瓶中一般要放入碎瓷片防止暴沸
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com