
科目: 来源: 题型:
【题目】在研究合成氨方法的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A. N2和H2在点燃或光照条件下可合成NH3
B. NH3和HNO3溶于水后都能导电,故二者都是电解质
C. NH3遇到浓硝酸会发生反应产生大量白烟
D. 由NH3制HNO3的过程中,氮元素被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
(1)用B表示的平均反应速率为 , A的转化率为 .
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 , 混合气体平均相对分子质量(填“增大”、“减少”或“不变”).
(3)若开始时只加C和D各 ![]() mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
(4)若向原平衡体系再投入1mol A和1mol B,平衡(填“右移、左移或不移”).
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 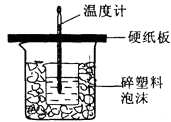
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是
(3)大烧杯上如不盖硬纸板,求得的中和热数值 . (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”).
简述理由 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于食物酸碱性的说法正确的是( )
A.食物本身具有酸味,即为酸性食物
B.蔬菜、水果等均属于酸性食物
C.蛋白质中含N、P、S等元素,其中氮元素最终变成硝酸
D.在人体代谢后最终生成碱性物质的食物,称为碱性食物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.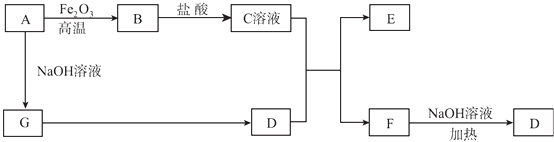
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示: 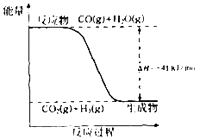
①反应的热化学方程式为 .
②已知:C(s)+H2O (g)═CO(g)+H2(g)△H=+131kJmoL﹣1
则C(s)+CO2(g)═2CO(g)△H= .
(2)化学反应可视为旧键断裂和新键形成的过程.:已知N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;N﹣H键的键能是391.55kJ/mol..则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H= .
H2(g)═NH3(g)△H= .
(3)在25℃、101Pa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,在3支相同体积的试管中分别充有体积比为4:1的2种混合的气体,它们是: ①NO和NO2②NO2和O2③NH3和N2,现将3支试管均倒置于水槽中,充分反应后,试管中溶液物质的量浓度之比为
A. 1:1:1 B. 5:4:4 C. 4:4:5 D. 5:4:5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关硅材料的说法不正确的是( )
A. 晶体硅是良好的半导体材料和制作太阳能电池的材料
B. SiO2可用于制造光导纤维
C. 普通玻璃是以纯碱、石灰石和石英为原料经高温烧结而制成的
D. SiO2是酸性氧化物,它可溶于水生成硅酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下:Ⅰ.方法一:
(1)浓硫酸试剂瓶上适合贴上的标签是(填序号).
(2)甲同学取6.4 g铜片和10 mL 18 molL﹣1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲同学为了验证其中白色沉淀主要成分.设计下列实验:实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:;
实验结论:所得白色固体的化学式为 .
(3)乙还观察到加热过程中,起初液面以上出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失.淡黄色固体消失的原因是(用化学反应方程式回答) . 直到最后反应完毕,发现试管中还有铜片剩余.乙根据自己所学的化学知识,认为试管中还有硫酸剩余.他这样认为的理由是 .
(4)Ⅱ.方法二:丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 ![]() 2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是① , ② .
2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是① , ② .
(5)方法三:丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.写出反应的化学反应方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com