
科目: 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJmol1和283.0 kJmol1 , 则CO(g)的ΔHm0=。
(2)合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =81.0 kJmol1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)=。
②已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1126.5(填“>”或“<”);其判断理由是。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示: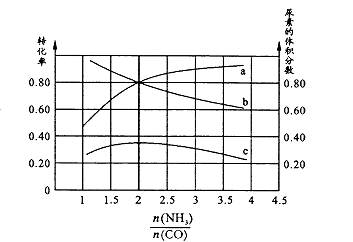
若图中c表示平衡体系中尿素的体积分数,则a表示的转化率。
当 ![]() =时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
=时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 molL1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为(已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
Co3+氧化HCOOH的离子方程式为;
忽略体积变化,电解前后Co2+的浓度将(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):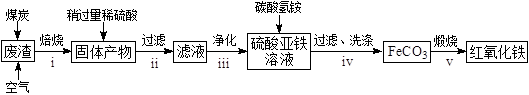
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN , 方案如下:![]()
若试纸变蓝则证明食品中含有CN , 请解释检测时试纸中FeSO4的作用。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应mA(固)+nB(气)Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( ) 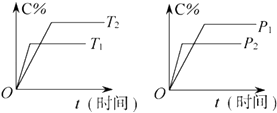
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】铁酸盐MFe2O4与H2在高温下反应生成新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价)。已知铁酸盐MFe2O4被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2:1。则下列说法中不正确的是
A. MFe2Ox是还原产物
B. MFe2Ox 中的+2价铁和+3价铁的物质的量之比为1:3
C. x=3.5
D. 若反应中消耗H2(标准状况下)33.6L,则转移的电子为3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
A.x=1
B.2 min内A的反应速率为0.3 mol/(Lmin)
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示: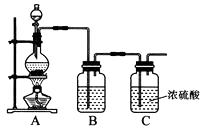
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为。
②实验室制Cl2时,装置B中盛放的试剂为 , 其作用是。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。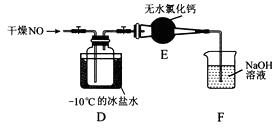
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。
②装置D中的现象为。
③装置E中无水氯化钙的作用为。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
(3)NO可用间接电化学法除去,其原理如下图所示:
①阴极的电极反应式为。
②吸收塔内发生反应的离子方程式为。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:(1)C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
(2)CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol
O2(g)═CO2(g)△H=﹣283.0kJ/mol
则反应:C(s)+ ![]() O2(g)═CO(g)的△H 是( )
O2(g)═CO(g)的△H 是( )
A.﹣221 kJ/mol
B.﹣110.5 kJ/mol
C.+110.5 kJ/mol
D.+221 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com