
科目: 来源: 题型:
【题目】下列反应中,不能体现酸的通性的反应是
A. Fe+H2SO4=FeSO4+H2↑
B. AgNO3+HCl=AgCl↓+HNO3
C. CaO+2HNO3=Ca(NO3)2+H2O
D. C + 2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程: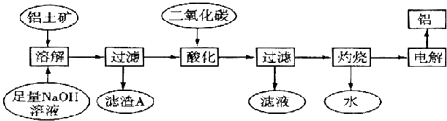
已知:①铝土矿的主要成分是Al2O3 , 此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为、 .
(2)滤渣A的主要成分是;硅铝酸盐沉淀写成氧化物的形式是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 .
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 .
(5)若将铝溶解,下列试剂中最好选用(填编号).
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 , 配位数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.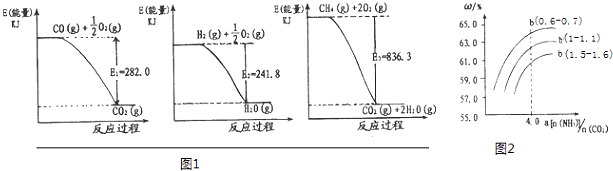
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .
查看答案和解析>>
科目: 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( ) ![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: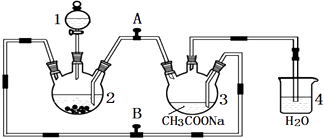
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 . A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.48g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com