
科目: 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g)2C(g),经2s后测得C的浓度为0.6molL﹣1 , 下列几种说法中正确的是( )
A.用物质A表示反应的平均速率为0.3 molL﹣1s﹣1
B.用物质B表示反应的平均速率为0.3 molL﹣1s﹣1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.3 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
已知:2NO2+2NaOH→NaNO3+NaNO2+H2O
NO+NO2+2NaOH→2NaNO2+H2O
(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为mol/L,需要质量分数为w%,密度为ρg/cm3的浓硝酸mL(均用最简分式表示).
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少L才能使生成的气体吸收完全(均用最简分式表示).
(3)丙组取某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).列式计算原混合酸中硝酸的物质的量是多少?硫酸的物质的量浓度多少?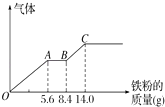
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 金属氧化物都能和水反应
B. Fe(OH)3 胶体带正电
C. 往 Fe(OH)3 胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解
D. Fe(OH)3 胶体能够吸附水中悬浮的固体颗粒沉降,达到消毒目的
查看答案和解析>>
科目: 来源: 题型:
【题目】用饱和FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,生成棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
D.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
(1)青蒿素的分子式为 .
(2)为了引入过氧基 ![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)步骤①③的作用是 .
(4)C8H10O3的结构简式: .
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式 .
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应.
(6)苄基乙醛 ![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用) . 已知:羰基α﹣H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用) . 已知:羰基α﹣H可发生反应: ![]()

查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.2NA
C. 标准状况下,1.12L 的SO3所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以烯烃为原料可以合成多种高聚物的合成路线如下:
已知:烯烃和X2在一定条件下能发生取代,且能发生双烯合成如 ![]() .
.
请回答下列问题:
(1)X中含有的官能团为;
(2)Y→Z的化学方程式为;
(3)高聚物E的结构简式为;甲是A的一种同分异构体,其能实现转化: ![]() ,甲的名称为;
,甲的名称为;
(4)由 ![]() 可以合成
可以合成 ![]() .按合成路线的顺序,涉及反应的反应类型有: .
.按合成路线的顺序,涉及反应的反应类型有: .
查看答案和解析>>
科目: 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是酸的酸酐,Cl2O电子式为 .
(2)下列能判断Cl和O两种元素非金属性强弱的是(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,其离子方程式是 , 氧化产物 . (填离子符号)
(5)一定条件下,在水溶液中1mol Cl﹣、ClO ![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示).
(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示). 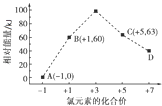
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升分)表示,则正确的关系是( )
A.![]() ν(NH3)=ν(O2)
ν(NH3)=ν(O2)
B.![]() ν(O2)=ν(H2O)
ν(O2)=ν(H2O)
C.![]() ν(NH3)=ν(H2O)
ν(NH3)=ν(H2O)
D.![]() ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com