
科目: 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的
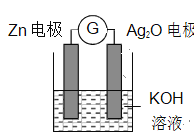
A. K+向正极移动
B. Ag2O 电极发生还原反应
C. Zn 电极的电极反应式:Zn-2eˉ+2OHˉ===Zn(OH)2
D. 放电前后电解质溶液的碱性保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组利用如图装置进行某些气体的制备和性质实验,图中加持装置有省略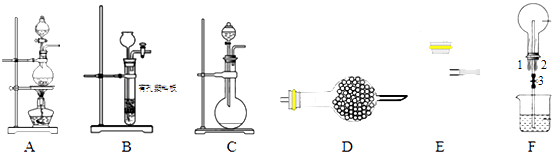
(1)为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气和氨气反应,实验室打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 .
(4)利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 . 若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是 .
(5)将装置B、C分别于F相连后,进行硫化氢和二氧化硫反应的实验,烧杯中的试剂所起的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应(假设空气中的N2和O2体积比为4:1)①3FeS2+8O2→Fe3O4+6SO2 ②4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 .
(2)某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%.每天能生产98%的硫酸吨
(3)硫铁矿煅烧过程中空气用量不同时,发生反应和生成炉气中SO2含量也不同,含FeS2 72%的硫铁矿在空气中煅烧并按反应①完全反应,列式计算炉气中的SO2的体积分数最大为多少?
(4)为确保SO2转化为SO3的转化率,某硫酸厂使用富氧空气(空气中加纯氧)煅烧硫铁矿,炉气中SO2和O2的体积分数分别达到11%和9%,FeS2完全转化为Fe2O3 , 列式计算富氧空气中的氧气体积分数为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】喹硫平可用于精神疾病的治疗,它的合成路线如下:
(1)A属于烃,相对分子式量为54,A的结构简式为
(2)反应①﹣﹣⑤中属于取代反应的有 , 反应⑦的化学方程式为
(3)流程中设计反应⑤和⑦的目的是
(4)物质C的同分异构体中,既含有羟基,又含有醛基的同分异构体有种
(5)已知:苯环上的羧基为间位定位基,如 ![]() 写出以甲苯为原料制备
写出以甲苯为原料制备  的合成路线 .
的合成路线 .
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式
(1)氯化镁_________________________ (2)硫酸氢钠_____________________
(3)碳酸氢钠 _____________________ (4)硫酸铝______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA
B. 标准状况下,22.4 L氖气含有原子数为Na
C. 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA
D. 标准状况下,11.2L H2O含有0.5NA分子
查看答案和解析>>
科目: 来源: 题型:
【题目】对于 Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应,下列 叙述错误的是
A. 反应过程中能量关系可用下图表示

B. 若将该反应设计成原电池则锌为负极
C. ΔH 的值与反应方程式的化学计量数有关
D. 若将其设计为原电池,当有 32.5g 锌溶解时,正极放出气体一定为 11.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用.如图是利用乙酰丙酸 ![]() 合成聚芳酯E的路线:
合成聚芳酯E的路线: 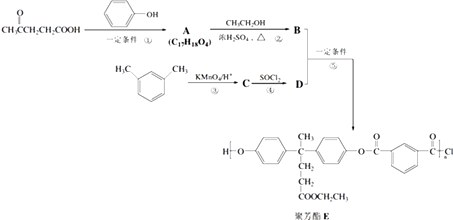
已知: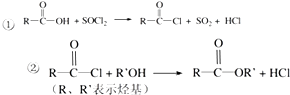
(1)乙酰丙酸中含有的官能团是羰基和(填官能团名称).
(2)D的结构简式为 .
(3)下列关于有机物B的说法错误的是a.能发生取代反应 b.能与浓溴水反应c.能发生消去反应 d.能与H2发生加成反应
(4)A→B的化学方程式为 .
(5)C的分子式为 , F是符合下列条件的C的同分异构体①能发生银镜反应 ②能与NaHCO3溶液反应
③分子中有四种化学环境不同的氢原子 ④苯环上只有2个取代基,无 ![]() 结构
结构
写出其中任一种与足量NaOH溶液共热反应的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 molL-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 1 molL-1的NaCl B. 75 mL 2 molL-1的NH4Cl
C. 150 mL 3 molL-1的KCl D. 75 mL 2 molL-1的CaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y.X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2 , 其水溶液呈弱酸性.完成下列填空
(1)A元素的不同原子有;B原子的核外电子占据了个轨道
(2)C原子核外最外层的电子排布式 , C2和过量X反应的化学方程式 , 每生成1mol单质,转移的电子物质的量为mol
(3)D2的化学性质稳定,原因是
(4)组成为的物质B4A3D2中所含的化学键有 , 其水溶液中各离子浓度大小顺序为
(5)液态X能自身电离,其阴离子电子式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com