
科目: 来源: 题型:
【题目】2005年美国化学会刊报道,美国俄勒冈大学的化学家使用了一种新型催化剂,在常温常压下合成氨,反应可表示为N2+3H2 ![]() 2NH3△H<0,有关说法正确的是( )
2NH3△H<0,有关说法正确的是( )
A.该反应△H<0,△S<0,在任何条件下均可自发进行
B.新法合成氨不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成氨能在常温下进行是因为不需要断裂化学键
D.使用此新型催化剂能让该反应进行完全
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是____,非金属性最强的元素是____。
(2)化学性质最不活泼的元素是____,其原子结构示意图为__________。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是______________________________。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是___________________
(5)在③④⑥三种元素中,离子半径由大到小的顺序是___________________。
(6)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是___________________。
(7)请设计实验证明⑦原子得电子能力比⑥原子强_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列八种物质: HCl、NH4Cl、N2、Na2O2、CaCl2、Cl2、NaF、CO2。
(1)只含有离子键的物质是______(填化学式,下同)。
(2)既含有离子键,又含有共价键的物质是______。
(3)属于共价化合物的是____,其中所有原子都满足8电子结构的是_____。
(4)写出NaF的电子式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、H、O三种元素在人体内质量分数约为93%左右,而在组成岩石圈的化学成分中还不到1%,这一事实说明了 ( )
A.生物界与非生物界具有相似性B.生物界与非生物界的元素组成是不同的
C.生物界与非生物界具有统一性D.生物界与非生物界存在差异性
查看答案和解析>>
科目: 来源: 题型:
【题目】利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( ) 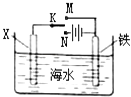
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe﹣2e﹣→Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e﹣→H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
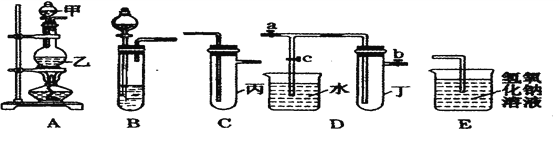
(1)将A、C、E相连后,以浓盐酸和_______(填写名称)为原料制取Cl2,仪器乙的名称是________。写出实验中制备氯气的离子方程式___________________。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):___________________________________________。
实验Ⅱ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):______________________________________________。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是______________________________________________________________。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先______________________________,再____________________________以使烧杯中的水进入试管丁,观察现象。
查看答案和解析>>
科目: 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4 , 过滤;
Ⅱ.向滤液中加入过量MnO2 , 过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是
(2)将MnO2氧化Fe2+的离子方程式补充完整: MnO2+ Fe 2++ ═ Mn 2++ Fe 3++
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 .
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 .
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4﹣与Mn2+反应生成MnO2 . 取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】离子方程式CO32-+2H+=H2O+CO2↑ 表示 ( )
A. 碳酸盐与盐酸之间的反应 B. 一切碳酸盐与一切酸之间的反应
C. 可溶性碳酸盐与酸之间的反应 D. 可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
(1)以N2 和H2 为原料合成氢气的反应为:N2(g)+3H2(g)2NH3(g)△H=QkJ.mol﹣1 . 已知N﹣N 键键能为946kJ.mol﹣1 , H﹣H键键能为436kJ.mol ﹣1 , N﹣H键键能为391kJ.mol﹣1 , 则Q= .
(2)将体积均为560mL(标准状况下)的SO2 和Cl2 同时缓慢通水中,得到1.0L溶液,则溶液pH= .
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3溶液中,阴离子的电离程度较小的是(填化学式),原因是
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是(填化学式,下同),阳极区放出的混合气体的成分为 . 
(5)氨水是一种常见的沉淀剂.向1.0L2.0×10﹣4mol.L﹣1的MgCl2 溶液中通入 (不考虑溶液体积的变化),有白色沉淀生成.
①写出生成白色沉淀的离子方程式
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为 mL.(已知实验条件下NH3 . H2O的电离平衡常数为1.8×l0﹣5 , Ksp[Mg(OH)2]=1.8×10﹣11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com