
科目: 来源: 题型:
【题目】硼及其化合物在工农业生产中应用广泛.
(1)基态硼原子的核外电子排布式为 , 有种不同能量的电子.
(2)BF3溶于水后.在一定条件下可转化为H3O+[B(OH)F3]﹣ , 该物质中阳离子的空间构型为 , 阴离子的中心原子轨道采用杂化.
(3)与BH4﹣互为等电子休的分子是(写化学式).
(4)EminBF4的熔点为12℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]﹣构成.该物质的晶体属于晶体.
(5)一种由硼和钐(Sm)形成的晶体的晶胞结构如图所示,已知晶胞常数a=n pm,则晶体的密度为gcm﹣3(设NA为阿伏伽德罗常数的值). 
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
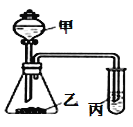
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
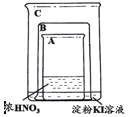
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
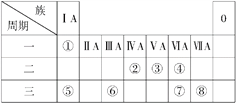
Ⅰ.(1)请画出元素⑧的离子结构示意图: _______________。
(2)⑦和⑧的最高价氧化物对应水化物的酸性强弱为______>______(填化学式)。
(3)④⑤两种元素的原子按1∶1组成的常见化合物的电子式为________。
Ⅱ.常见物质A、B、C均含有表中①~⑧中的一种或几种元素,可发生以下反应(副产物已略去),试回答:
![]()
![]()
![]()
![]()
![]()
(1)若X是强氧化性单质,则A可能是______ (填序号)。
a.S b.Na c.Al d.NH3 e.CH4
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀。写出反应②的化学方程式: ____________________。
(3)若A、B、C为含有同一金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,写出A与C两溶液反应的离子方程式: _____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
一种工业合成氨的简易流程图如下: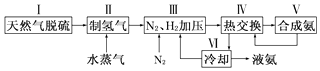
(1)在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 . 升高平衡体系的温度(保持体积不变),该反应(填“逆向移动”正向移动”或“不移动”).
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 .
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 .
a.升高温度 b.增大压强 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量.若2mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为
查看答案和解析>>
科目: 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 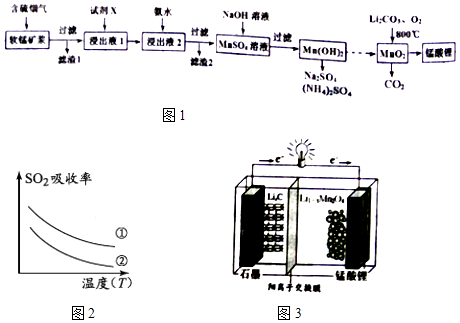
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1: 
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=kJ/mol.反应Ⅲ的化学方程式为 .
(2)从废钒催化剂中回收V2O5的过程如图2: 
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式 .
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为[25℃,Ksp(NH4VO3)=1.6×10﹣3 , 溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液. ①向此溶液稀溶液中再加入少量(NH4)2SO4固体, ![]() 将(填“变大”、“不变”或“变小”).
将(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 ![]() =(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
=(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
查看答案和解析>>
科目: 来源: 题型:
【题目】将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( ) 
A.n=1.0
B.水的电离程度:b>c>a>d
C.c点:c(NH4+)=c(Cl﹣)=1.0molL﹣1
D.25℃时,NH4Cl的水解常数(Kh)=(n﹣1)×10﹣7
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素A、B的质子数分别是a和b,它们的离子Am+和Bn-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m-nB. a=b-m+nC. a=b+m+nD. a=b-m-n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com