
科目: 来源: 题型:
【题目】按要求完成下列反应的方程式
(1)工业上用氮气和氢气直接合成氨的化学方程式______________
(2)氨被氧化生成一氧化氮的化学反应方程式______________
(3)碳酸氢铵受热分解______________
(4)过量的铁和稀硝酸反应的离子方程式______________
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: ![]() =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关.现有反应:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃时,K=1.
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关.现有反应:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃时,K=1.
(1)若升高温度到950℃时,达到平衡时K1(填“大于”“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2 , 则:
①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目: 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中逐滴加入60 mL NaOH溶液至Cu2+恰好完全沉淀,则NaOH溶液的浓度是
A. 3 mol·L-1 B. 4 mol·L-1
C. 5 mol·L-1 D. 6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B2C,在反应过程中C的物质的量分数随温度变化如图所示: 
(1)T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反应的正反应为热;(填“放”或“吸”)
(3)X、Y两点A物质正反应速率的大小关系是YX;
(4)温度T<T0时,C%逐渐增大的原因是:;
(5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g) ![]() CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1;
②H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
③CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量(填“多”或“少”).
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图
请你写出△H1、△H2、△H3、△H4之间存在的关系式 .
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实行垃圾分类,关系生活环境改善和节约使用资源。下列说法正确的是
A.回收厨余垃圾用于提取食用油
B.对废油脂进行处理可获取氨基酸
C.回收旧报纸用于生产再生纸
D.废旧电池含重金属须深度填埋
查看答案和解析>>
科目: 来源: 题型:
【题目】FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、NO和H2O,当NO2与NO的物质的量之比为6:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 2:11 B. 1:6
C. 1:7 D. 1:8
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: 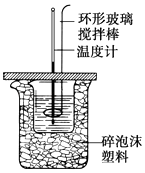
(1)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”).结合日常生活的实际该实验在中进行效果更好.
(2)实验中改用60m L 0.50molL﹣1盐酸与 50m L 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50m L 0.5molL﹣1 NaOH溶液进行上述实验,测得的中和热的数值会 . (均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO ![]() .下列离子反应方程式正确的是( ) ①NaClO溶液中通入少量二氧化碳:2ClO﹣+CO2+H2O═2HClO+CO
.下列离子反应方程式正确的是( ) ①NaClO溶液中通入少量二氧化碳:2ClO﹣+CO2+H2O═2HClO+CO ![]()
②Na2CO3溶液中加入HClO溶液:CO ![]() +HClO═HCO
+HClO═HCO ![]() +ClO﹣
+ClO﹣
③等物质的量的Cl2与Na2CO3溶液恰好反应:Cl2+CO ![]() +H2O═HCO
+H2O═HCO ![]() +Cl﹣+HClO
+Cl﹣+HClO
④Cl2通入NaHCO3溶液中:Cl2+2HCO ![]() ═2CO2↑+Cl﹣+ClO﹣+H2O.
═2CO2↑+Cl﹣+ClO﹣+H2O.
A.②④
B.①③
C.②③
D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com