
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.KMnO4溶液用盐酸酸化并加入H2O2:2MnO ![]() +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
B.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO ![]() +Ba2++3OH﹣=BaSO4↓+Fe(OH)3↓
+Ba2++3OH﹣=BaSO4↓+Fe(OH)3↓
C.等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH﹣=Al(OH)3↓+3H2O
D.水玻璃与稀醋酸混合:SiO ![]() +2H+=H2SiO3↓
+2H+=H2SiO3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1
水的汽化热△H=+44kJmol﹣1
据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式;
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为 , 曲线与曲线对应的压强P1P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简).下列各项中能说明反应已达到平衡状态的是 . a.混合气体的平均相对分子质量不变 b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变 d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式: . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案(图1和图2)进行实验探究:
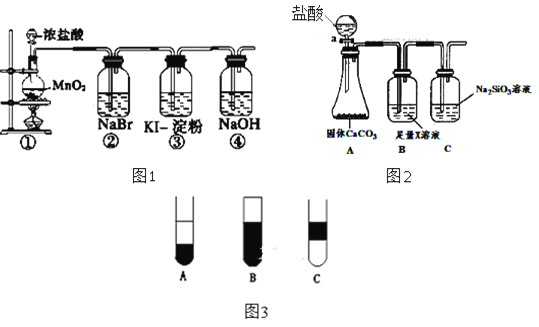
(1)根据方案一装置(图1)回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:______。
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与图3吻合的是______。(填字母代号)
Ⅲ.装置③中的现象是______。
(2)根据方案二装置(图2)回答以下问题:
Ⅰ.B装置的作用是______,X是______。
Ⅱ.能说明碳元素和硅元素非金属性强弱的实验现象是______。
(3)实验结论:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设汁下列实验方案鉴别Na2CO3和NaHC03两种白色粉末,不能达到预期目的是( ) 
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末用如图所示装置进行实验,比较澄清石灰水是否变浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题:
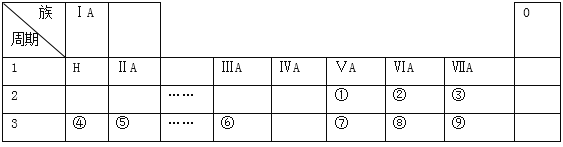
(l)②表示的元素是 ______ (填元素符号).
(2)②③④⑤⑧和⑨这六种元素的简单离子半径由小到大排序为:__________(用离子符号表示);上表所示元素中,非金属性最强的是 ______ (填元素符号);⑦⑧⑨这三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序为:_______________(填分子式)
(3)元素⑨的单质可以用来制取漂白粉,漂白粉的有效成分是 ______ (填化学式);用电子式表示元素⑤与⑨形成化合物的过程 ______ .
(4)上述元素中,单质能与水剧烈反应且水作还原剂,此单质是_________(填化学式)
(5)写出元素④的最高价氧化物对应的水化物与元素⑥的最高价氧化物相互反应的化学方程式 ______ .
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
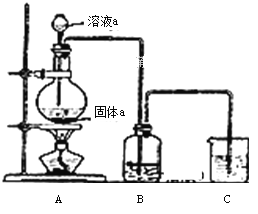
① 装置B中溶液的溶质为______(写化学式).
② 装置C中盛放烧碱稀溶液,目的是______.反应的离子方程式是______
查看答案和解析>>
科目: 来源: 题型:
【题目】工业利用含有Al2O3、SiO2和少量FeOxFe2O3的铝灰制备硫酸铝晶体与三草酸合铁酸钾[K2Fe(C2O4)33H2O]在的流程如图所示:
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 3.6 | 2.1 |
完全沉淀时 | 5.2 | 3.2 |
回答下列问题:
(1)为提高酸浸速率,应采用的措施是(答出两条) , 残渣的主要成分是;
(2)写出氧化过程中反应的了新方程式;
(3)试剂X的化学式是 , pH的调控范围是;
(4)操作Ⅱ的晶体步骤为 , 过滤洗涤、低温干燥,若操作Ⅰ与操作Ⅱ相同,则洗涤三草酸合铁酸钾以获得干燥晶体的试剂最好是;a.先热水后酒精 b.先冷水后酒精 c.先酒精后热水 d.先酒精后冷水
(5)生成MnCO3沉淀的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】一水合硫酸四氨合铜(Ⅱ)[Cu(NH3)4]SO4)H2O为深蓝色晶体,在工业上用途广泛,常用作杀虫剂、媒染剂.某学习小组探究制备该晶体并测定其组成的实验过程如下:(Ⅰ)晶体的制备原理及流程:
CuSO4+4NH3+H2O═[Cu(NH3)4]SO4)H2O
回答下列问题:
(1)无水乙醇的作用;烘干晶体的温度性质60℃的原因是;
(2)实验制得产物晶体中往往有Cu2(OH)2SO4杂质,分析产生该杂质的原因可能是;
(3)(Ⅱ)晶体中溶解于酸性溶液中,加入NaI溶液,Cu2+可与I作用产生I2和白色沉淀,该反应的离子方程式为 , 再用Na2S2O3溶液滴定I2 , 即可得Cu2+含量;
(4)(Ⅲ)晶体中氮含量的测定实验装置如图所示,称取0.9380g[Cu(NH3)x]SO4H2O晶体[M=(178+17x)g/mol]于锥形瓶a中,通过分液漏斗向锥形瓶a中滴加10%NaOH溶液,用1.000mol/L的NaOH标准滴定b中剩余的HCl.
滴定管读数如图所示,消耗标准液mL;[Cu(NH3)x]SO4H2O中x= , 推测测量值(x)比理论值偏小的原因是;
(5)(Ⅳ)SO42﹣含量的测定﹣﹣沉淀法称取一定质量的试样,加稀盐酸溶解,将BaCl2加入溶液中,静置得到BaSO4沉淀,检验沉淀已完全的操作为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】E是一种重要的高分子酯,其合成线路如图1所示,其中A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2 , A的核磁共振氢谱有3组峰;B与X互为同分异构体;1molC发生银镜反应时最多可得到4molAg.
已知:(如图2所示)
(1)A的名称是 , 1molB最多消耗molNaOH;
(2)出现X的结构简式 , C中官能团的名称是;
(3)D→E的化学方程式为;
(4)D有多种同分异构体,其中符合下列条件的同分异构体(不考虑立体异构)的有种,写出其中核磁共振氢谱有5组峰的结构简式;
①能与浓溴水发生取代反应;②能发生水解反应.
(5)以C和乙烯为基本原料,经如图3所示变化可得到一种用途广泛的酯类增塑剂G:
①试剂I是;
②工业上发生I的试剂与条件是;
③若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则G的分子式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com