
科目: 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-![]() NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________。
(2)反应中硝酸体现了_____、_____性质。
(3)若反应中转移的电子总数为0.15 NA(NA是阿伏加德罗常数的值),则产生的NO在标准状况下的体积是_____ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)△H
(1)已知:H2和CO的燃烧热(△H)分别为﹣285.8kJ.molL﹣1和﹣283.0kJ.molL﹣1;
C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(I)△H=+114.8kJmol﹣1
则制取苯乙烯反应的△H为
(2)向密闭容器中加入1mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ.下列说法正确的是 .
A.升高温度,正反应速率减小,逆反应速率增大
B.若继续加入1mol乙苯,苯乙烯转化率增大
C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,达平衡时反应能量变化为(△H﹣Q)kJ
(3)向2L密闭容器中加入1mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示.700℃时,乙苯的平衡转化率为 , 此温度下该反应的平衡常数为;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是 .
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2 , 该阳极的电极反应式为 , 若去除0.5mol苯乙烯,两极共收集气体mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( ) 
A.某盐溶液可能是Mg(NO3)2溶液
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.甲池是b极上析出金属银,乙池是c极上析出某金属
D.某盐溶液可能是CuSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”。关于月光穿过薄雾所形成的种种美景的说法不正确的是
A. 空气中的小水滴颗粒大小约为10﹣9m~10﹣7mB. 光是一种胶体
C. 雾是一种胶体D. 发生丁达尔效应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物的俗名和类别均正确的是
A. Na2CO3:纯碱、碱B. CaO:熟石灰、碱性氧化物
C. NaHCO3:小苏打、盐D. KAl(SO4)2·12H2O:明矾、混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置及做法对环境友好的是( )

①实验室中用(a)装置收集氨气 ②实验室中用(b)装置做氯气与钠反应的实验 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸反应生成铵盐的实验 ④实验室中用(c)装置进行铜与稀硝酸的反应( )
A. ②③④ B. ①②③ C. ①②④ D. ①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品.我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如图所示.请回答: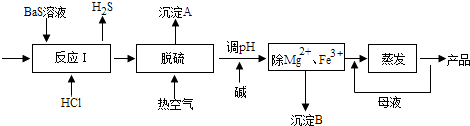
已知:室温时Ksp[Mg(OH)2]=1.8×10﹣11 Ksp[Fe(OH)3]=4.0×10﹣38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为 .
(2)所得氯化钡粗液中含硫化合物(H2S、HS﹣等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是;沉淀A的主要成分是 .
(3)热空气吹除时会有部分HS﹣转变为S2O32﹣ , 使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为 .
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l05molL﹣1时认为该离子完全沉淀),应将溶液的pH调至(只列算式)以上.
(5)实验室测定产品中x的步骤如下:
①准确称取12.23gBaCl2xH2O样品,加入l00mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmolL﹣1H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2﹣3次;
③将沉淀充分干燥后称量,质量为11.65g.
检验BaSO4沉淀是否洗涤干净的方法是;经计算x的数值为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不正确的是( )
A. 组成生物体的化学元素种类大体相同
B. 不同种类的生物体内各种元素的含量相差很大
C. 微量元素含量不多,缺少它们对生命活动影响不大
D. 生物体内常见的化学元素在元素周期表中原子序数较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com