
科目: 来源: 题型:
【题目】下列两组热化学方程式中,有关△H的比较正确的是( ) ①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
②NaOH(aq)+ ![]() H2SO4(浓)═
H2SO4(浓)═ ![]() Na2SO4(aq)+H2O(l)△H3
Na2SO4(aq)+H2O(l)△H3
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H4 .
A.△H1>△H2;△H3>△H4
B.△H1>△H2;△H3<△H4
C.△H1=△H2;△H3<△H4
D.△H1<△H2;△H3<△H4
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( ) 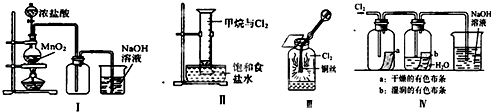
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在生产、生活中有广泛的应用.
(1)铜可采用如下方法制备:火法炼铜:Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被(填“氧化”或“还原”)成铜单质.
(2)印刷电路板上使用的铜需要回收利用.方法一:用FeCl3溶液浸泡印刷电路板制备CuCl22H2O,实验室模拟回收过程如下:![]()
①证明步骤Ⅰ所加FeCl3溶液过量的方法是 .
②步骤2中所加的氧化剂最适宜的是 .
A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 . (写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl22H2O.
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=﹣320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=﹣196kJ/mol
H2(g)+ ![]() O2(g)═H2O(l)△H3=﹣286kJ/mol
O2(g)═H2O(l)△H3=﹣286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H= .
(3)欲实现反应Cu+H2SO2═CuSO4+H2 , 在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A.配制0.10molL﹣1NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2 , 分出水层后的操作 | D.记录滴定终点读数为12.20mL |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 aAn、 b B(n1) 、cC n 、d D(n1) 具有相同的核外电子排布, 则 a 、b 、 c 、 d 由大到小的顺序是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下: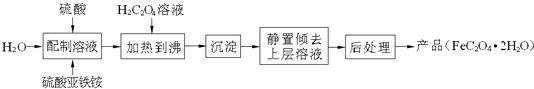
(1)配制(NH4)2Fe(SO4)26H2O溶液时,需加少量硫酸,目的是 .
(2)沉淀时发生反应的化学方程式为 .
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为 .
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示: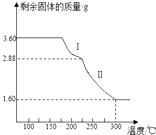
①过程Ⅰ发生反应的化学方程式为 .
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式(写出计算过程).
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3(s)的热化学方程式为 .
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K= .
②取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H(填“>”、“<”或“=”,下同)0.
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠKⅡ .
(3)以CO2为原料还可以合成多种物质.①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 . 开始以氨碳比 ![]() =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 .
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 .
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 .
③将足量CO2通入饱和氨水中可得氮肥NH4HCO3 , 已知常温下一水合氨Kb=1.8×10﹣5 , 碳酸一级电离常数Ka=4.3×10﹣7 , 则NH4HCO3溶液呈(填“酸性”、“中性”或“碱性”).
查看答案和解析>>
科目: 来源: 题型:
【题目】Science 杂志在2017年春节发表了南京理工大学的论文,报道了世界上首个成功合成的五氮阴离子盐 (N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料中里程碑式的突破。该盐可简略表示如下,下列分析不合理的是( )
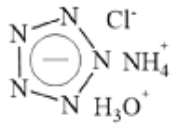
A. 五氮阴离子的化学式为 ![]() B. 该盐中氮元素的化合价均为-3价
B. 该盐中氮元素的化合价均为-3价
C. 该盐遇强碱能释放出NH3 D. 该盐中五氮阴离子具有还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子的检验能达到预期目的是( )
A. 检验![]() :先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
:先滴加氯水,再滴加KSCN溶液,若变红,则有Fe2+
B. 检验NH4+:先滴加NaOH溶液,加热,用湿润蓝色石蕊试纸检验,若变红,则有NH4+
C. 检验Cl—:先滴加AgNO3溶液,再滴加硝酸,若有白色沉淀,则有Cl—
D. 检验![]() :滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有
:滴加硝酸,将生成的气体通入品红溶液,若品红溶液褪色,则有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com