
科目: 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示. 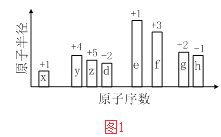
根据判断出的元素回答问题:
(1)f在元素周期表的位置是 .
(2)比较d、e常见离子的半径的小(用化学式表示,下同)>;比较g、h的最高价氧化物对应的水化物的酸性强弱是:> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol 单质e在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1molL1R溶液的烧杯中滴加1molL1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图2如下: 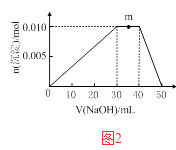
①写出m点反应的离子方程式 .
②若R溶液改加20mL1.2molL1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组溶液,能在强酸性或强碱性中都能大量共存且无色的离子组是
A. Cu2+、K+、CO32-、NH4+ B. Ba2-、Na+、SO42-、NO3-
C. Na+、H+、HCO3-、Cl- D. K+、Na+、NO3-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法不正确的是
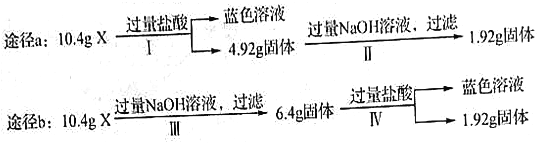
A. 由图可知X中可能存在Fe2O3 B. 可以判断混合物中是否含有Al2O3
C. 1.92g固体成分为Cu D. 依图可以计算Fe2O3和Cu的质量
查看答案和解析>>
科目: 来源: 题型:
【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】在溶液中可进行反应A+B![]() C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是

A. 该反应是吸热反应
B. 反应速率最大的时间段是在t1~t2
C. 四个时间段内生成C的量最多的是t1~t2
D. 反应速率后来减慢主要是受反应物浓度变化的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】天津港爆炸致大量氰化钠(NaCN)泄露,NaCN是剧毒物质.专家们使用双氧水(H2O2)来处理氰化钠,反应方程式如下:H2O2+NaCN+H2O═NaHCO3+NH3
(1)若有0.49吨 NaCN泄露至少需要质量分数为34%的H2O2溶液吨进行处理 (假设H2O2的处理效果是100%,且不考虑H2O2自身分解)
(2)相比于双氧水,漂白粉(主要成分Ca(ClO)2)的价格要便宜的多,若处理相同质量的NaCN(生成物相同)需要消耗Ca(ClO)2mol(假设Ca(ClO)2的处理效果是100%)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度中,将1 molA 和2mol B放入容积为5L 的某密闭容器中发生反应:A(s) +2B(g)![]() C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
A. 在5min 内该反应用C 的浓度变化表示的反应速率为0.02mol/(L·min)
B. 平衡时B 的转化率为50%
C. 平衡时B 的体积分数约为33.3%
D. 初始时的压强与平衡时的压强比为4 :5
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( ) 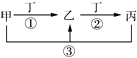
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,则丙可能可以作为医疗上治疗胃酸过多症的药剂
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目: 来源: 题型:
【题目】将1mol纯净的A置于真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解达到平衡:A(s)![]() 2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
A. 反应速率:vB(正)=vc(逆) B. B的体积分数不变
C. 气体的密度保持不变 D. 混合气体的平均摩尔质量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com