
科目: 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为 .
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2 , 此反应的离子方程式为 , 在标准状况下,吸收112L Cl2需要molNa2SO3 .
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,经洗涤、灼烧、冷却、称重.试写出测定无水AlCl3产品纯度的过程中有关反应的离子方程式: , .
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl36H2O脱去结晶水制备无水AlCl3 , 实现这一步的操作方法是 .
(5)工业上铝土矿经提纯后可冶炼铝,写出在950﹣970℃和Na3AlF6作用下进行电解制铝反应的化学方程式 .
(6)升华器中加入Al,这一步的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H= .
(2)科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 .
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
(4)所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣的影响.①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ . 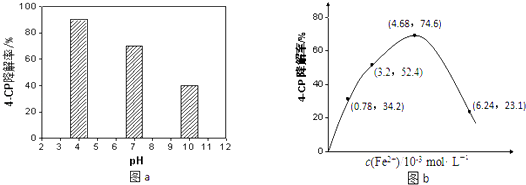
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4molL﹣1、c(Na2S2O8)=3.12×10﹣3 molL﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣发生反应,消耗部分SO4﹣.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3molL﹣1时,4﹣CP降解的平均反应速率的计算表达式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1 molH2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJmol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJmol
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置制取NH3,并用AlCl3溶液吸收多余NH3制Al(OH)3,最后回收NH4Cl,能达到实验目的的是

A. 用装置甲制取NH3
B. 用装置乙吸收NH3制取Al(OH)3
C. 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌
D. 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 65g
C.气体A中SO2和H2的体积比为1:4
D.反应中共转移电子2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是( )
A.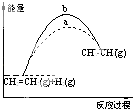 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2 . 则△H1>△H2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( ) 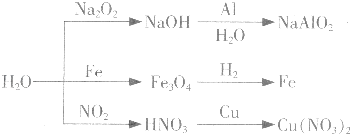
A.如图所示的反应均为氧化还原反应
B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱
C.工业上常用NO2与水的反应原理制取硝酸
D.实验室中可用铜与稀硝酸反应制取NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
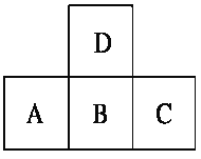
A. 原子半径的大小顺序是C > B > A > D
B. B、D之间只能形成一种化合物
C. 只有A的单质存在同素异形体
D. A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C > B > A
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 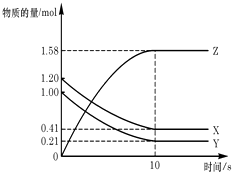
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com