
科目: 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 ![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中.
(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol﹣l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol﹣l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 , 该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率可v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020molL﹣l , 在该条件下达到平衡时,CO的转化率为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 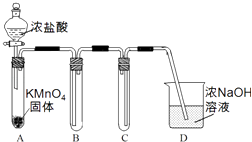
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 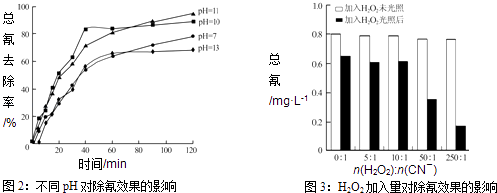
(1)电解处理法 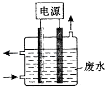
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
(1)As的原子结构示意图为 ![]() ,则其在周期表中的位置是 .
,则其在周期表中的位置是 .
(2)N元素非金属性比As强,下列说法正确的是 . ①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
(3)根据如图写出As2O5分解为As2O3的热化学方程式 . 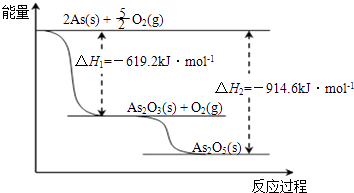
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3 , 提取的工艺流程简图如下: 
①As2S3、Na3AsS3中的S均为﹣2价,碱浸过程中发生的反应(填“是”或“不是”)氧化还原反应.
②过程Ⅲ的系列操作包括 .
③写出过程Ⅲ的离子方程式 ,
过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因 .
查看答案和解析>>
科目: 来源: 题型:
【题目】“张﹣烯炔环异构化反应”被《Name Reactions》收录.该反应可高效合成五元环状化合物: 
(R1代表氢原子或烃基,X代表氧原子或氮原子)
某五元环状化合物I( 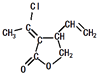 )的合成路线如下:
)的合成路线如下: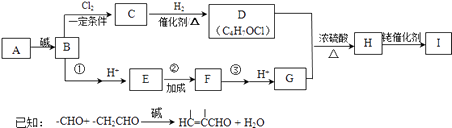
(1)烃的含氧衍生物A的相对分子质量为44,核磁共振氢谱显示分子中含有两种氢,则A的名称为 .
(2)A→B的化学反应方程式为 .
(3)写出D顺式结构的结构简式 , B→C的反应类型为 .
(4)写出H的结构简式 .
(5)①的化学试剂是 .
(6)写出③的化学方程式 .
(7)下列说法正确的是 . a.H→I的过程中涉及到单键、双键和三键的断裂以及单键和双键的形成
b.C,D,E,F均能使溴的四氯化碳溶液褪色
c.与F含有相同官能团的同分异构体有8种(不含F本身)
查看答案和解析>>
科目: 来源: 题型:
【题目】在水溶液中,下列电离方程式书写错误的是
A.NaHCO3=Na++H++CO32-
B.Ba(OH)2=Ba2++2OH-
C.NaHSO4=Na++H++SO42-
D.BaCl2=Ba2++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
请回答:
(1)O点导电能力为0的理由是 .
(2)a、b、c三点处,溶液中c(H+)由小到大的顺序为 .
(3)a、b、c三点处,醋酸电离程度最大的是点.
(4)若使c点溶液中的c(CH3COO﹣)提高,下列措施中不可行的是
A.加热
B.加稀盐酸
C.加固体KOH
D.加水
E.加Zn粒
F.加固体CH3COONa
G.加MgO
I.加固体Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com