
科目: 来源: 题型:
【题目】下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )

A. 该装置将化学能转化为电能,电流方向为b![]() a
a
B. 催化剂b表面O2发生还原反应,其附近酸性增强
C. 催化剂a表面的反应是:SO2+2H2O-2e-=SO42-+4H+
D. 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意填空
(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.可选试剂:①0.1molL﹣1KI溶液;②0.1molL﹣1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4 .
实验步骤:①取5mL 0.1molL﹣1 KI溶液,再滴加5~6滴0.1molL﹣1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4 , 用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂(填试剂序号),若现象为 , 该反应有一定的限度.
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 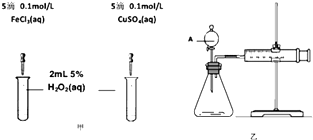
①定性分析:如图甲可通过观察(填现象),定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3溶液更为合理,其理由是 . 写出H2O2在二氧化锰作用下发生反应的化学方程式: .
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中一定需要测量的数据是(填序号).
①收集40mL气体所需要的时间 ②CuSO4溶液和FeCl3溶液的浓度 ③过氧化氢溶液的浓度.
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意填空
(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.可选试剂:①0.1molL﹣1KI溶液;②0.1molL﹣1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4 .
实验步骤:①取5mL 0.1molL﹣1 KI溶液,再滴加5~6滴0.1molL﹣1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4 , 用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂(填试剂序号),若现象为 , 该反应有一定的限度.
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 
①定性分析:如图甲可通过观察(填现象),定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3溶液更为合理,其理由是 . 写出H2O2在二氧化锰作用下发生反应的化学方程式: .
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中一定需要测量的数据是(填序号).
①收集40mL气体所需要的时间 ②CuSO4溶液和FeCl3溶液的浓度 ③过氧化氢溶液的浓度.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知断裂1mol H2(g)中的H﹣H键需要吸收436.4KJ的能量,断裂1mol O2(g)中的共价键需要吸收498KJ的能量,生成H2O(g)中的1mol H﹣O键能放出462.8KJ的能量.下列说法正确的是( )
A.断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量
B.2H2(g)+O2(g)═2H2O(g)△H=﹣480.4 KJ?mol﹣1
C.2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ?mol﹣1
D.H2(g)+ ![]() O2(g)═H2O(l)△H=﹣240.2KJ?mol﹣1
O2(g)═H2O(l)△H=﹣240.2KJ?mol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度为0.1mol/L、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图回答下列问题:
(1)该温度时氨水的电离平衡常数K= .
(2)比较b、c、d三点时的溶液中,水电离 的c(OH﹣)大小顺序为 .
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 .
A.c(H+)c(OH﹣)
B.![]()
C.![]()
D.![]()
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和 NH3H2O两种形式) .
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3H2O)+c(OH﹣)
B.点 c所示溶液中:c(Cl﹣)=c(NH3H2O)+c(NH4+)
C.点 d所示溶液中:c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.滴定中可能有:c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+)
(5)滴定过程中所用盐酸的pH= , d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( ) 
A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物对应水化物的酸性依次降低
C.WH4与Z元素的单质在一定条件下可能发生化学反应
D.W的位置是第2周期、第ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示 
(1)若改变反应条件,在某条件下a(I2)的变化如曲 线(I )所示,则该条件可能是:(填序号)
①恒容条件下,升高温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(2)该温度下此化学反应的化学平衡常数为 .
(3)在图基础上画出恒容条件下,降低温度,I2的转化率a(I2)随时间变化的曲线 .
(4)若在原平衡的基础上,保持体系温度不变,再往体系中通入1.4mol I2(g)和0.6mol HI(g),计算再次达到平衡时I2(g)的物质的量.(写出计算过程,已知最后结果保留2位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度为0.1mol/L、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图回答下列问题:
(1)该温度时氨水的电离平衡常数K= .
(2)比较b、c、d三点时的溶液中,水电离 的c(OH﹣)大小顺序为 .
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 .
A.c(H+)c(OH﹣)
B.![]()
C.![]()
D.![]()
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和 NH3H2O两种形式) .
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3H2O)+c(OH﹣)
B.点 c所示溶液中:c(Cl﹣)=c(NH3H2O)+c(NH4+)
C.点 d所示溶液中:c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.滴定中可能有:c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+)
(5)滴定过程中所用盐酸的pH= , d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com