
科目: 来源: 题型:
【题目】公元前一世纪,我国已使用天然气,天然气的主要成分为甲烷。下列关于甲烷的叙述中,错误的是
A. 通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B. 甲烷化学性质比较稳定,不能被任何氧化剂氧化
C. 甲烷跟氧气反应无论生成CH3Cl、CH2Cl、CHCl3还是CCl4,都属于取代反应
D. 甲烷的四种取代物都难溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A.浓溶液一定是饱和溶液
B.析出晶体的溶液是饱和溶液
C.任何物质的饱和溶液,加热后都变成不饱和溶液
D.饱和溶液中,溶质的溶解速率大于结晶速率
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法制备NaClO2固体的实验装置如图1所示. 已知:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
ClO2熔点﹣59℃、沸点11℃;H2O2沸点150℃
请回答:
(1)仪器A的作用是;冰水浴冷却的目的是(写两种).
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Clˉ存在时会催化ClO2的生成.反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气.该过程可能经两步完成,请将其补充完整:①(用离子方程式表示),②H2O2+Cl2═2Cl﹣+O2+2H+ .
(4)H2O2浓度对反应速率有影响.通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备.该设备的作用是 , 馏出物是 .
(5)抽滤法分离NaClO2过程中,下列操作不正确的是
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管,关闭水龙头.
查看答案和解析>>
科目: 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用. 请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJmol﹣12C(s)+O2(g)═2CO(g)△H2=﹣221KJmol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是 , 该反应自发进行的条件 .
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比). 反应ⅠCO2(g)+4H2(g)CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g)△H5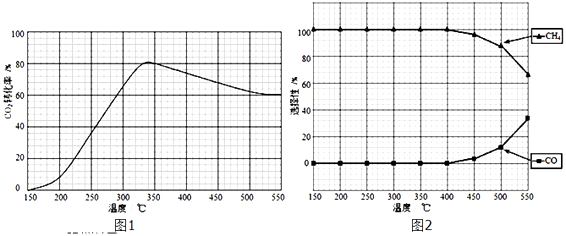
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为(用a、V表示)
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线. 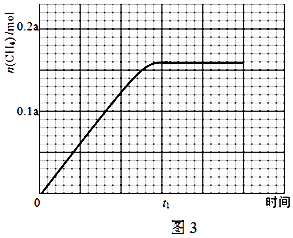
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图.混合物中n[(NH4)2SO4]:n(NH4Cl)为 . 
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl﹣=(溶液体积变化忽略不计).
查看答案和解析>>
科目: 来源: 题型:
【题目】FeSO4受热分解的化学方程式为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑ 请回答:
Fe2O3+SO2↑+SO3↑ 请回答:
(1)将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2 . 能说明SO2存在的实验现象是;为测定BaSO4沉淀的质量,后续的操作步骤依次为、洗涤、干燥、称重.
(2)设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应) . 
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moLL﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( ) 
A.1:1:1
B.2:2:1
C.2:1:1
D.1:1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律.
用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.

(1)过氧化氢的电子式:_______________;
(2)从图1中选择氧气的制备装置______,反应前需要的操作是:________________;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示)_____________;
(4)你认为能证明Cl的非金属性强于S的是___________
a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体混合物中可能含有:K+、Na+、Clˉ、CO32﹣、SO42﹣等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是( ) 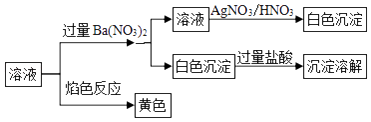
A.该混合物一定是K2CO3和NaCl
B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3
D.该混合物一定是Na2CO3和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com