
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH ![]() CH2═CH2
CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | ﹣1l6 |
回答下列问题: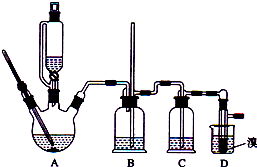
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是;
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,使海水分解得到氢气的新技术:
2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,实现了从________能转变为________能。生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于_______反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是________,发生的电极反应为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
(1)混合物中NaOH的物质的量为 ,
(2)混合物中AlCl3质量为 ,
(3)混合物中MgCl2质量为 ,
(4)P点表示盐酸的体积是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
(1)原溶液中c(H2SO4)= mol/L
(2)若a=2.3mL,计算各组分的质量:
m(Al2O3)= g;m(Fe2O3)= g;
(3)计算a值的取值范围: <a< .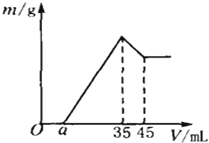
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________;
(2)反应最剧烈的烧杯中金属是_______(填字母序号);
A.钠 B.镁 C.铝 D.钾
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题
(1)实验装置:

(1)填写所示仪器名称:B__________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的单质为密度最小的气体 |
Y | Y的氢化物的水溶液呈碱性 |
Z | Z是地壳中含量最高的元素 |
W | W的一种核素的质量数为35,中子数为18 |
(1)W在元素周期表中的位置_________________。
(2)X与Y可形成一种化合物Y2X4,请写出该化合物的电子式__________,工业合成Y的简单氢化物的化学方程式为________________。
(3)X和Z组成的既含有极性共价键又含有非极性共价键的化合物的结构式是______________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________
(4)写出铜和Y的最髙价氧化物的水化物的稀溶液反应的离子方程式______________。
(5)W最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子发生转移时,共产生9 mol气体,写出该反应的化学方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_______________,装置乙中正极的电极反应式是___________。
(2)四种金属活泼性由强到弱的顺序是_____________________________________。
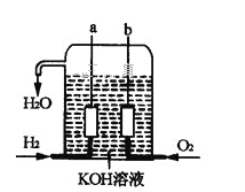
Ⅱ.美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中a、b两个电极均由多孔的碳炔组成,该电池的负极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com