
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
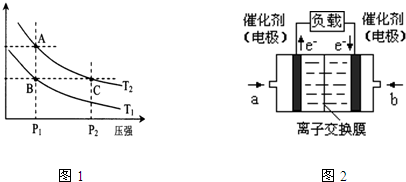
查看答案和解析>>
科目: 来源: 题型:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |
查看答案和解析>>
科目: 来源: 题型:
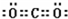
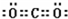
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | J | k |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com