
科目: 来源: 题型:
【题目】在甲、乙两烧杯溶液中,分别含有大量Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯溶液中大量存在的离子是
A. K+、OH﹣、CO32﹣ B. CO32﹣、OH﹣、Cl﹣
C. K+、H+、Cl﹣ D. Cu2+、H+、Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
请填写下列空白:
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到,量筒内形成一段水柱,认为有氯化氢生成。
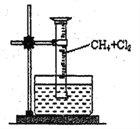
(1)该反应的反应类型为_____________________。
(2)该反应的化学方程式为(只写第一步)______________。
(3)水槽中盛放的液体应为_______。(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
(4)该实验的实验现象为:____________、_____________、试管壁上出现油状液滴
(5)该油状液滴中含有的有机产物共有_______种。
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉锭生成,认为有氯化氢生成。
(6)你认为该实验设计得出的结论是否正确的______,若不正确,理由是:_________________。
[实验三]步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同),测得pH=3.26
步骤二:收集一试管甲垸和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入l0mL蒸馏水,充分振荡,测得pH=1.00。
(7)判断该反应中有氯化氢生成的依据是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度之比为( )
A. 15∶2 B. 1∶1 C. 3∶1 D. 1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三组混合液:①苯和水②乙醇和丁醇③单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有(写两条).
(2)恒温恒容条件能说明该可逆反应达平衡的是;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中冲入1molCO(g)和2molH2(g).实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示.
①该反应的△S0,图中的T1T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为 , 若达到平衡状态B时,则容器的体积V(B)=L.
(4)已知:H2(g)燃烧热△H=﹣285.8KJmol﹣1、和CO(g)燃烧热△H=﹣283.0KJmol﹣1 , 则CH3OH(g)燃烧热的热化学方程式是为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题

(1)金属性最强的元素是_______(填元素符号),写出表中所绘元素的氧化物中具有两性的氧化物与表中所给的元素中碱性最强的最高价氧化物的水化物的离子反应:____________________。
(2)元素的非金属性:M_____R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是__________________________。
(4)F、G两元素形成的淡黄色固体物质的电子式为_______,该物质含有的化学键的类型是____________________。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是________________(填离子符号)。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理. 已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3回答下列问题:
(1)氰化物中碳的化合价为;用硫代硫酸钠处理1mol NaCN时,反应中转移电子的物质的量为.
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是.
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放. 【实验一】制备Na2S2O3 , 其实验室装置如下:
①b装置的作用是;c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3 , 还可能有 .
②实验结束后,在e处最好连接盛(填化学式)的注射器,再关闭K2打开K1 , 以防拆除装置过程中的有害气体污染空气.
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量.
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN﹣=[Ag(CN)2]﹣ , Ag++I﹣=AgI↓,AgI呈黄色,且CN﹣优先于Ag+反应.
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10﹣4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL.
③滴定时1.000×10﹣4mol/L的标准AgNO3溶液应用(填仪器名称)盛装;滴定终点时的现象是 .
④处理后的废水是否达到排放标准:(填“是”或“否”),其依据是(用实验数据说明).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com