
科目: 来源: 题型:
【题目】已知:R﹣CH=CH﹣O﹣R′ ![]() R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图:
R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图: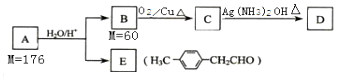
请回答下列问题:
(1)A的分子式为 , B的名称是 .
(2)写出C→D反应的化学方程式: .
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在某个容积为2L的密闭容器内,在T℃时按图1所示发生反应: 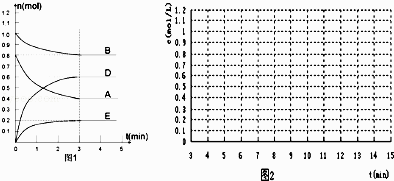
mA(g)+nB(g)pD(g)+qE(s)H<0(m、n、p、q为最简比例的整数).
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为mol/(Lmin); 方程式中m:n:p:q=
(2)该反应的化学平衡常数K为(保留至一位小数);
(3)下列措施能增大B的转化率的是 A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E.保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是 A.恒容恒温时容器中气体压强保持不变 B.混合气体中D浓度不变
C.v(A)正=v(A)逆 D.恒容时容器中气体密度不变
(5)反应达到平衡后,第7min时,改变条件,在第9min达到新的平衡,在图2上作出第7min至第15min 下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再分别滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属小块,观察现象。
①甲同学设计实验的目的是:研究同一周期及同一主族,金属元素的原子_______ 电子能力递变规律。
②实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法__(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
③写出d烧杯中发生反应的离子方程式____________________。
(2)已知元素非金属性越强,其最高价含氧酸的酸性就越强。乙同学设计了下图装置以验证碳、氮、硅元素的原子的非金属性强弱。
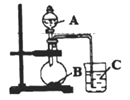
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是一种强酸,常温下可与铜反应;B是块状固体;烧杯中盛放C的溶液。打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。
①写出所选用物质的化学式:A__________、C_________________;
②写出烧杯中发生反应的化学方程式:____________________。
(3)丙同学认为乙同学的实验方案不能达到实验目的,还需采取的改进措施为:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学键的说法正确的是( )
A.在MgBr2晶体中既存在离子键又存在共价键
B.单质中均不存在化学键
C.离子键是阴、阳离子通过静电作用而形成的化学键
D.都由非金属元素组成的化合物里不可能存在离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】甘油是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1.26g/mL,沸点约290℃,分离水和甘油最合理的方法是( )
A. 蒸馏 B. 蒸发 C. 过滤 D. 分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 天然气 | 硫酸 | 干冰 |
B | 氢氧化钡 | 蔗糖溶液 | 碱石灰 | 三氧化硫 |
C | 胆矾 | 石灰水 | 苛性钾 | 氨气 |
D | 硫酸 | 铝合金 | 氯化钠 | 氢气 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇. ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1
②CO(g)+2H2(g)CH3OH(g)△H2
将0.20mol CH4(g)和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图.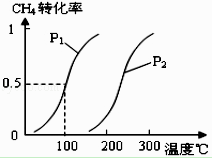
(1)温度不变,缩小体积,增大压强,①的反应速率(填“增大”、“减小”或“不变”),平衡向方向移动.
(2)温度升高,反应①的△H10(填“<”、“=”或“>”),其平衡常数表达式为K= , 100℃时的平衡常数值是 .
(3)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定温度下,在密闭容器内进行某化学反应,气体X、Y的物质的量随反应时间变化的曲线如图所示。

①写出该反应的化学方程式_____________________。
②在t1和t2时正反应速率分别为v1和v2,则二者大小关系为v1________v2 (填“>”、“ <”或“=”)。
③在t1、t2和t3三个时刻中,反应限度最大的是________(填“t1”、“ t2”或“t3”)。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
①下列描述能说明该可逆反应达到化学平衡状态的有_______。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
②若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内N2表示的反应速率为________;此时H2的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com