
科目: 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:
(1)反应N2(g)+3H2(g)2NH3(g)△H<0;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡,图1图象能正确表示该过程中相关量的变化的是 . (选填字母). 
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ![]() ,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
(3)2NO(g)+O2(g)2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2). ①比较P1、P2的大小关系:P1P2(填“>”、“<”或“=”).
②随温度升高,该反应平衡常数变化的趋势是 .
(4)硝酸厂常用如下2种方法处理尾气. ①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 . 若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A. ①②③④ B. ②③④⑥ C. ③④⑧⑨⑩ D. ②⑤⑦⑨⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于四个图象的说法正确的是( ) 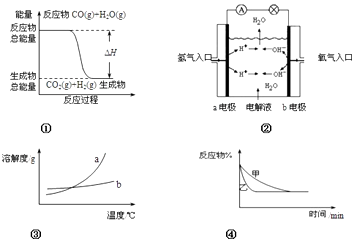
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
查看答案和解析>>
科目: 来源: 题型:
【题目】马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2 , 还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图: 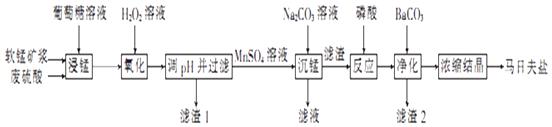
(1)软锰矿要先制成矿浆的目的是 , 葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为 .
(2)用H2O2溶液“氧化”时发生反应的列子方程式为 .
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为 , 滤渣1的主要成分为(填化学式).
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为 .
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐t.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列保存试剂的方法中,错误的是( )
A.漂粉精保存在烧杯中B.新制的氯水保存在棕色瓶中,避光
C.氢氧化钠溶液保存在带木塞的试剂瓶D.碘单质保存在棕色瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2(g)完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4(g)完全燃烧生成液态水和CO2气体,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6﹣2 | +5﹣3 | ﹣2 | +3 |
(1)R的元素符号为; M在元素周期表中的位置为 .
(2)X与Y按原子个数比1:1构成的物质的电子式为;所含化学键类型 .
(3)X+ , Y2,M2离子半径由大到小的顺序为(用离子符号表示) .
(4)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的电极反应式 .
Ⅱ如图转化关系A ![]() B
B ![]() C,若B为白色胶状不溶物,则A与C反应的离子方程式为 .
C,若B为白色胶状不溶物,则A与C反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com