
科目: 来源: 题型:
【题目】以下是氮循环的一部分: 
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】向X溶液中加入Y试剂,产生沉淀或气体如图,与所述情形几乎完全相符的是( )

A. 向HCl和AlCl3的混合液滴加NaOH溶液 B. 向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C. 向NaOH和Ca(OH)2混合液中通入CO2 D. 向NaOH和Na2CO3混合液滴加稀HCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为L,NO2的体积为L.
(2)将产生的气体全全释放后,向溶液中加入VmLamolL﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为molL﹣1 .
(3)若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
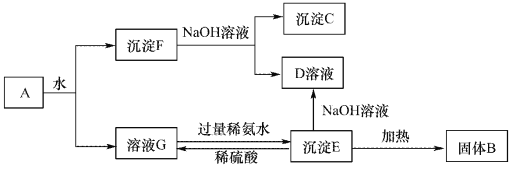
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
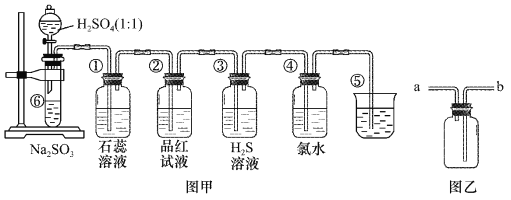
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ___________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,硝酸只表现氧化性的是( )
A.3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O
B.C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Al(OH)3+3HNO3═Al(NO3)3+3H2O
D.3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
【答案】D
【解析】令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2↑,气体体积减小△V
2 1 1
a b 4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余,
所以:3.36L气体中CO2体积为4.48L-2.24L=2.24L,O2的体积为1.12L,
所以4.48L气体的质量为![]() ×44g/mol+
×44g/mol+![]() ×32g/mol=6.0g。答案选D。
×32g/mol=6.0g。答案选D。
点睛:本题考查根据方程式的计算,难度中等,本题采取差量法计算,可以避免单独讨论或计算判断最后气体的组成,注意差量法的理解与运用。根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=![]() 计算各组分气体的物质的量,利用m=nM计算质量。
计算各组分气体的物质的量,利用m=nM计算质量。
【题型】单选题
【结束】
26
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
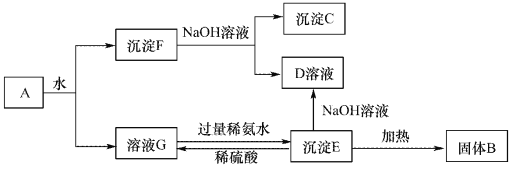
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ?mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ?mol﹣1
B.已知:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
C.已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJ?mol﹣1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)?H2O(l)
△H=﹣57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=﹣114.6kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中出现大量固体时即停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com