
科目: 来源: 题型:
【题目】硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式;H2
还原SiHCl3过程中若混有O2 , 可能引起的后果是。
(2)下列有关硅材料的说法正确的是( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,
振荡。写出实验现象并给予解释(用化学方程式说明)。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷
B.生物陶瓷
C.导电陶瓷
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组变化中,只有加入酸才能一步实现的是( )
A. Zn→ZnSO4 B. CuO→CuCl2
C. CaCO3→CO2 D. NaOH→Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】我国明代《本草纲目》冲收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和精人甑,蒸令气上……其清如水,球极浓烈,盖酒露也。”这里所用的“法”悬指
A. 萃取 B. 过滤 C. 蒸馏 D. 干馏
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.
(2)沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .
(3)加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500molL﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 都比较稳定,密封放置不产生沉淀 B. 都有丁达尔效应
C. 加入少量NaOH溶液都可产生沉淀 D. 分散质微粒均可透过滤纸
查看答案和解析>>
科目: 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为; 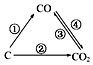
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F﹣F | N﹣F |
键能/kJmol﹣1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的△H=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=﹣235.8kJmol﹣1 ,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJmol﹣1 ,
则O3转化为O2的热化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】《本草纲目》中记载“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取其露。”这里用到的方法可用于分离( )
A.碳酸钙和硝酸钾B.碘单质和氯化钠C.四氯化碳和水D.乙醇和乙酸
查看答案和解析>>
科目: 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A. K+、Na+、NO3-、MnO4- B. Mg2+、Na+、Cl-、SO42-
C. K+、Na+、Cl-、Cu2+ D. Na+、Ba2+、OH-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和 . 泡沫塑料的作用是 .
(2)若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液;氨水(NH3H2O) .
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由题干及图形可知,V1:V2=时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com