
科目: 来源: 题型:
【题目】聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分:FeS2,铁的化合价为+2价)烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(铁的化合价为+3价)的实验步骤如下:
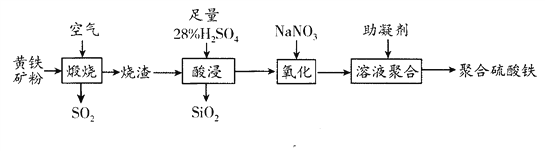
回答下列问题:
(1)用98%的浓硫酸配制28%的稀硫酸,需要的玻璃仪器除玻璃棒外,还需要________(填写仪器名称)。
(2)“煅烧”过程发生反应的氧化产物是___________________________;SO2氧化为SO3是工业生产硫酸的重要反应,写出该反应的化学方程式_______________________。
(3)写出“酸浸”过程中发生反应的离子方程式___________________________。
(4)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入NaNO3产生无色气体反应的离子方程式______________________________,若用H2O2代替NaNO3达到相同氧化效果,消耗H2O2和NaNO3的物质的量之比___________。
(5)为确定产品是否合格,需测定聚合硫酸铁中Fe3+和SO42-的物质的量之比,测定时需要的试剂为___________ (填写序号)。
a. FeSO4 b. BaCl2 c. NaOH d. NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. Ⅰ.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s) ![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品.
回答问题: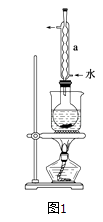
(1)硫粉在反应前用乙醇润湿的目的是 .
(2)仪器a的名称是 , 其作用是 .
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 . 检验是否存在该杂质的方法是 .
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: .
(5)Ⅱ.测定产品纯度 准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0molL﹣1碘的标准溶液滴定.
反应原理为2S2O ![]() +I2═S4O
+I2═S4O ![]() +2I﹣
+2I﹣
滴定至终点时,溶液颜色的变化:
(6)测定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为mL.产品的纯度为(设Na2S2O35H2O相对分子质量为M) . 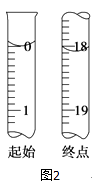
(7)Ⅲ.Na2S2O3的应用 Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ![]() ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
查看答案和解析>>
科目: 来源: 题型:
【题目】用O2将HCl转化为Cl2 , 可提高效益,减少污染.
(1)传统上该转化通过如图1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)H2O(g)+CuCl2(s)△H1 , 反应②生成1molCl2(g)的反应热为△H2 , 则总反应的热化学方程式为(反应热用△H1和△H2表示). 
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性. ①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 .
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由:
③下列措施中,有利于提高αHCl的有 .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10﹣3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以molmin﹣1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法不正确的是( ) 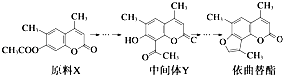
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与2 mol NaOH发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构,这三种烷烃的二氯取代产物的同分异构体数目分别是( ) 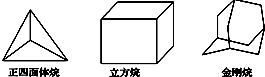
A.2种,4种,8种
B.2种,4种,6种
C.1种,3种,6种
D.1种,3种,8种
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5H2O和Fe3O4 , 还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 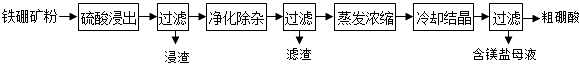
回答下列问题:
(1)写出Mg2B2O5H2O与硫酸反应的化学方程式 . 为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条).
(2)利用的磁性,可将其从“浸渣”中分离.“浸渣”中还剩余的物质是(化学式).
(3)“净化除杂”需先加H2O2溶液,作用是 . 然后在调节溶液的pH约为5,目的是
(4)“粗硼酸”中的主要杂质是(填名称).
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为 .
(6)单质硼可用于生成具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程 .
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是人类最早使用的金属之一,请结合已有知识回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出FeCl3溶液与金属铜发生反应的离子方程式__________________________。
(2)铜能与浓硫酸反应,写出反应的化学方程式_______________________;将生成的气体通入硫化氢水溶液中,其现象为__________________________。
(3)铜能与浓硝酸反应,写出反应的离子方程式___________________;用干燥大试管集满NO2(标准状况下),倒置于水槽中,假设进入试管内的溶液不扩散到水槽中,则试管中溶质的物质的量浓度是______________________molL-1;
(4)工业上火法炼铜过程中发生的主要反应为:2Cu2O+Cu2S=6Cu+SO2↑,当生成19.2 g Cu时,反应转移电子_________________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com