
科目: 来源: 题型:
【题目】请按下列要求填空:
(1)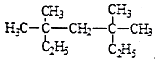 系统命名法为;
系统命名法为;
(2)键线式 ![]() 表示的有机物的结构简式是;
表示的有机物的结构简式是;
(3)醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是 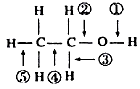
①和金属钠作用时,断裂;
②和浓硫酸共热至170℃时,断裂;
③和乙酸、浓硫酸共热时,断裂;
④在铜催化下和氧气反应时,断裂;
⑤与氢卤酸反应时,断裂;
(4)分子质量为70的烯烃的分子式为 , 若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是( )
A.化学反应能够制造出新的物质,但不能制造出新的元素
B.“血液透析”利用了胶体的性质
C.只要符合限量,“食用色素”“亚硝酸盐”可以作为某些食品的添加剂
D.在食品袋中放入盛有生石灰的透气小袋,可防止食物受潮、氧化变质
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)═4PCl3(g)△H=a kJmol﹣1 , P4(g)+10Cl2(g)═4PCl5(g)△H=bkJmol﹣1 , P4具有正四面体结构,PCl5中P﹣Cl键的键能为c kJmol﹣1 , PCl3中P﹣Cl键的键能为1.2c kJmol﹣1 . 下列叙述正确的是( )
A.P﹣P键的键能大于P﹣Cl键的键能
B.可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H
C.Cl﹣Cl键的键能为 (b﹣a+5.6c)/4 kJmol﹣1
D.磷元素的非金属性比氯强
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景.
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为﹣285.5kJ/mol、﹣283kJ/mol和﹣1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2 , 将悬浮物带到水面,利于除去.实验室以二甲醚燃料电池模拟该方法设计的装置如图所示: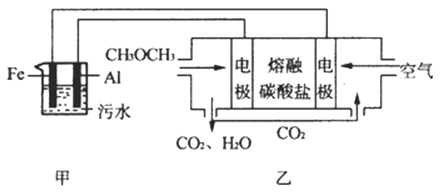
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极.写出该燃料电池的正极电极反应式 下列物质可用做电池熔融碳酸盐的是
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:
③已知常温下Kap[Fe(OH)3]=4.0×10﹣38 , 电解一段时间后,甲装置中c(Fe3+)=
④已知:H2S的电离平衡常数:K1=9.1×10﹣8、K2=1.1×10﹣12;H2CO3的电离平衡常数:K1=4.31×10﹣7、K2=5.61×10﹣11 . 测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2﹣+H2O═CO32﹣+H2S
B.发生反应的离子方程式为:CO2+S2﹣+H2O═HCO3﹣+HS﹣
C.c(Na+)=2[c(H2S)+c(HS﹣)+c(S2﹣)]
D.c(Na+)+c(H+)=2c(CO32﹣)+2c(S2﹣)+c(OH﹣)
E.c(Na+)>c(HCO3﹣)>c(HS﹣)>c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害.对废旧电池进行资源化处理显得非常重要.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源.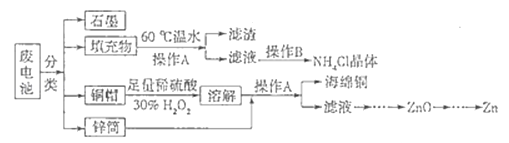
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是
(3)操作A的名称为
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2 .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:
根据图可知: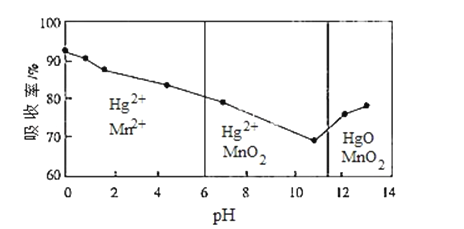
①pH对Hg吸收率的影响规律是
②在强酸性环境下Hg的吸收率高的原因可能是
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1-2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀.请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_________。
(2)本实验用到的基本仪器已有烧杯、天平托盘(带砝码、镊子)、玻璃棒,还缺少的仪器是_____、____、____。
(3)下列情况会使所配溶液浓度偏高的是(填序号)________。
a.某同学观察液面的情况如右图所示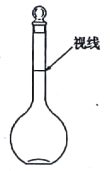
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目: 来源: 题型:
【题目】下列排列顺序不正确的是
A.原子半径:Si> Na>OB.热稳定性:HF> HCl> H2S
C.碱性:CsOH> KOH> NaOHD.失电子能力:K> Na> Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com