
科目: 来源: 题型:
【题目】把aL含(NH4)2SO4和NH4NO3的混和溶液分成两等份,一份加入b mol的烧碱并加热,恰好将全部NH4+转变成NH3放出;另一份需含c mol 的BaCl2溶液恰能完全沉淀SO42-,则原溶液中NO3-的物质的的浓度是( )
A. (2b-4c)/a mol/L B. (b-2c)/a mol/L
C. (2b-c)/amol/L D. (b-4c)/a mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下面试剂瓶中盛放的是某同学配制的硫酸亚铁溶液,请回答下列问题:

(1)配制该FeSO4溶液需用到这种仪器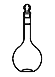 ,该仪器名称是____________;若配制500 mL该FeSO4溶液,则需要称量FeSO4固体_______g。
,该仪器名称是____________;若配制500 mL该FeSO4溶液,则需要称量FeSO4固体_______g。
(2)该同学取所配制的FeSO4溶液放于四支试管中(标号分别为①②③④),分别进行了如下实验,请按要求填写相应内容:
①号试管观察溶液颜色是__________色。
②号试管加入NaOH溶液时,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,写出这一过程中反应的化学方程式:____________;________________。
③号试管加入少量KSCN溶液,如果溶液变成红色,说明该溶液已变质,溶液中含有_____;可在变红的溶液中加入少量铁粉振荡,红色消失,其离子方程式为__________。
④号试管加入少量氯水,反应的离子方程式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大的A,B,C,D,E,F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24.
(1)F原子基态的核外电子排布式为 .
(2)在A,B,C三种元素中,第一电离能由大到小的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A,B,C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B,C,D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊;打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是( ) 
A.HCl和浓H2SO4
B.Cl2和氯水
C.Cl2和NaHCO3溶液
D.SO2和NaHCO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是多少?(要写计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”). 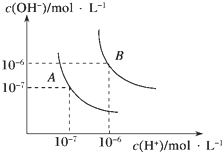
查看答案和解析>>
科目: 来源: 题型:
【题目】结合所学内容,完成下列问题:
(1)过氧化钠固体的颜色是______________。
(2)写出磁性氧化铁的化学式_____________,小苏打的化学式____________。
(3)写出实验室加热NH4Cl和Ca(OH)2的混合物制取NH3的化学方程式:_______。
(4)若要提取饱和碘水中的碘,所用的萃取剂可以是___________(填序号)。
① 四氯化碳 ② 酒精 ③ 淀粉溶液
(5)红热的木炭与浓硝酸反应的化学方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比为_________;如果产生标准状况下22.4 L CO2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验。
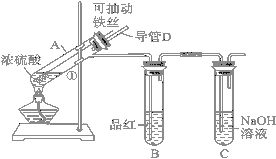
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是________________。
(2)说明SO2气体产生的实验现象是___________;装置C的作用是______________。
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
① 提出假设: 假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+。
② 请设计实验方案验证假设3。
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液。
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 |
|
步骤二:检验Fe3+,往试管Ⅰ中,_____________ | _________________________ |
步骤三:检验Fe2+,往试管Ⅱ中,______________ | _________________________ |
(4)已知C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序为_____________________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
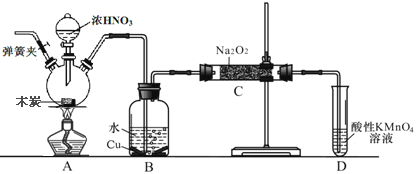
【题目】亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:
① 3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
② 酸性条件下,NO与NO2-都能与MnO4-反应生成NO3-和Mn2+;
(1)盛浓硝酸仪器的名称是___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式__________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为_______L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭_______g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
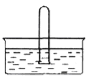
① NO2溶于水的化学方程式是______________________________________。
② 使试管中NO2完全被水吸收的操作是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com