
科目: 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W:________、X:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验或操作的叙述正确的是( )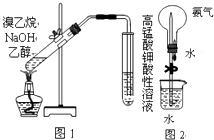
A.如图1,检验溴乙烷与NaOH水溶液共热产生的乙烯
B.如图2,做喷泉实验时先挤压胶头滴管,后松开止水夹
C.酸碱中和滴定前,滴定管和锥形瓶在用蒸馏水洗涤后均需用待装溶液润洗
D.用托盘天平称取1.06g无水碳酸钠,溶于250mL水,配制0.04molL﹣1Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制100mL 1.0molL﹣1Na2SO4溶液,正确的方法是( )
①将7.1g Na2SO4溶于50mL水中
②将32.2g Na2SO410H2O晶体溶于少量水中,然后再用水稀释至100mL
③将25mL4.0molL﹣1Na2SO4溶液溶于75mL水中
④将50mL2.0molL﹣1Na2SO4溶液加入到40mL水中,然后再用水稀释至100mL.
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO![]() 、NO
、NO![]() 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
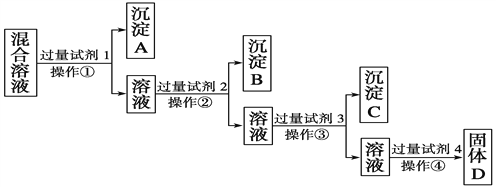
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓渡的NaOH溶液时,使所配制的溶液浓度偏小的操作是( )
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后末干燥,里面含有少量水
④读取容量瓶液面时采用俯视.
A.①②
B.③④
C.①③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是(设NA为阿伏伽德罗常数的数值)( )
A.20g重水含有10NA个电子
B.1L 0.1 molL﹣1 Na2SO3溶液中含有的SO32﹣数目少于0.1NA个
C.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
D.用足量铜粉除去FeCl2溶液中的FeCl3杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】根据问题填空:
(1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①②
(2)已知离子反应:
①H2A+B﹣=HA﹣+HB
②H2A+2C﹣=A2﹣+2HC
则H2A、HA﹣、HB、HC的酸性由强到弱的排列顺序为
(3)向含有等物质的量浓度的HCl、NH4Cl、AlCl3混合溶液中滴加NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化关系如图.试写出①OA段和②CD段发生反应的离子方程式:① . 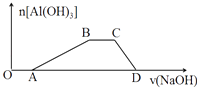
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1molL﹣1 NaOH溶液450mL和0.5molL﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①(填序号),配制上述溶液还需用到的玻璃仪器是②(填仪器名称).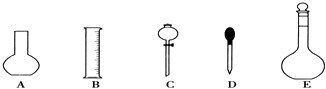
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1molL﹣1(填“大于”、“等于”或“小于”).
(3)由计算知,所需质量分数为98%、密度为1.84gcm﹣3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,在反应中被氧化与被还原的原子数之比为( )
A. 1∶2 B. 1∶4 C. 1∶1 D. 2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示。

(1)写出圆底烧瓶中发生反应的离子方程式
____________________________________________________。
(2)如果将过量二氧化锰与20mL12mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有①__________________________________,
②________________________________________。
(3)为了提高浓盐酸的利用率,你对该实验的建议是_________。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是____________________,有关的离子方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com