
科目: 来源: 题型:
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)【铁元素的分离】 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分溶解,过滤,滤液备用。
①浸泡液检测不出铁元素的原因是________。
②滤液中铁元素的存在形式是Fe2+、________。
(2)【配制溶液】 将滤液配制成100 mL 溶液。选择合适的仪器完成“铁元素的分离”、
“配制溶液”2个实验,下列仪器不必使用的是_______。

(3)【铁元素含量测定】 研学小组提出如下测量方案:
Ⅰ.沉淀法:向溶液中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。评价该测量方案是否可行________。
Ⅱ.比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是________。
② 溶液a的颜色是________。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量________(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。

可见,氧化还原反应能否发生与_________有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题: 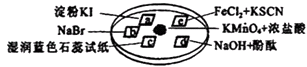
(1)上述反应中,元素的化合价升高;而元素被还原.
(2)配平上述反应: KMnO4+HCl(浓)═KCl+Cl2↑+MnCl2+H2O
(3)c处湿润蓝色石蕊试纸会先后 , 产生此现象的原因是: .
(4)e处滤纸的实验现象是: , 写出氯气与Fe2+反应的离子方程式是: .
(5)上述反应若在标准状况下产生56L的氯气,则转移电子为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中A为非金属元素;A和E属同一族,它们原子最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , C是 , D是 , E是 .
(2)由这五种元素组成的一种化合物是(写化学式) .
(3)写出C元素基态原子的电子排布式: .
(4)用电子排布图表示D元素原子的价电子排布为 .
(5)元素B与D的电负性的大小关系是BD,C与E的第一电离能的大小关系是CE.(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】N2经一系列过程可以得到HNO3和NH4HCO3,如下图所示。

(1)过程 ______ 属于“氮的固定”。
(2)过程Ⅱ,NH3和O2在催化剂作用下反应,其化学方程式是________。
(3)过程Ⅳ,为使NO2尽可能多地被水吸收,需不断的向反应器中通入________。
(4)NH4HCO3常用作铵态氮肥,但不宜在碱性较强的土壤中施用,原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的装置中,A是氯气发生仪器,C、D 为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液. 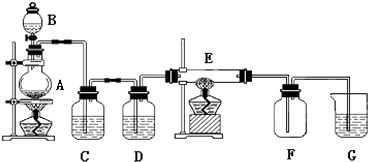
请回答下列问题:
(1)仪器A的名称是;
(2)实验室制氯气的化学方程式:MnO2+4HCl(浓);
(3)C装置的作用是;D装置的作用是;
(4)E中发生化学反应的方程式为:;
(5)烧杯G中发生反应的化学方程式为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的.请回答:
(1)A原子的核外电子排布图 , B原子的核外电子排布式 , C原子的价电子排布式 .
(2)A,B,C的气态氢化物的化学式分别是 , 其中最不稳定的是 .
(3)它们的最高价氧化物的水化物中,酸性最强的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下。
(1)检测锈蚀产物
主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. Fe转化为Fe2+ 。
Ⅱ. Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为_______。
Ⅲ. FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ. Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
![]() (将反应补充完整)___________
(将反应补充完整)___________
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
① 检测洗涤液中Cl-的方法是________。
② 脱氯反应:FeOCl + OH-=FeO(OH) + Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:________。
③ Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 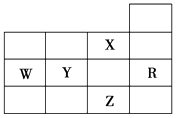
A.W元素的电负性大于Y元素的电负性
B.X元素是电负性最大的元素
C.p能级未成对电子最多的是Z元素
D.Y,Z的阴离子电子层结构都与R原子的相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
A.分别加入足量锌片,两种溶液生成H2的体积相同
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO﹣)和硫酸中的c(SO ![]() )相等
)相等
D.两种溶液中,由水电离出的氢离子浓度均为1×10﹣11 mol?L﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组用打磨过的铝片进行如下实验,下列分析不合理的是

A. ①中铝片发生了钝化
B. ②中产生的气泡可能是氮氧化合物
C. ③中沉淀溶解的离子方程式是Al(OH)3+ OH-=AlO2- + 2H2O
D. ②中加水稀释过程中,仅发生了氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com