
科目: 来源: 题型:
【题目】24mL浓度为0.05mol·L-1Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
A. +2 价 B. +3 价 C. +4价 D. +5价
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和条件被略去,A、 X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;B、C、E是常见气体,G的焰色反应呈黄色;I的溶液呈黄色。

请回答下列问题:
(1)写出下列物质的化学式A___、F___;
(2)说出黄绿色气体C的一种用途___;
(3)实验室检验H中所含的金属阳离子的方法是,先加___无明显现象,再加氯水,溶液变为___色;
(4)写出C与H溶液反应的化学方程式___.
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。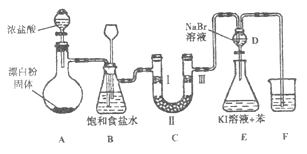
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是。
(5)装置F的烧杯中的溶液不能选用下列中的(填字母编号)。a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法中正确的是( )
A.12C、13C、14C是碳的三种同素异形体
B.H2S的电子式可表示为 ![]()
C.HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D.NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种短周期元素,A2﹣和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子. 回答下列问题:
(1)C原子的核外电子排布式为 .
(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A、B、D三元素组成的化合物所属的晶体类型是 .
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型为 .
(4)A和B能够形成化合物1:1的化合物,写出此化合物的电子式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】软锰矿(主要成分MnO2 , 杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4H2O,反应的化学方程式为:MnO2+SO2═MnSO4 .
(1)质量为17.40g纯净MnO2最多能氧化L(标准状况)SO2 .
(2)已知:Ksp[Al(OH)3]=1×10﹣33 , Ksp[Fe(OH)3]=3×10﹣39 , pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10﹣6molL﹣1),需调节溶液pH范围为 .
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4H2O晶体,需控制的结晶温度范围为 . 
(4)准确称取0.1710gMnSO4H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+ , 用c(Fe2+)=0.050molL﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.MnSO4H2O样品的纯度 .
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A. 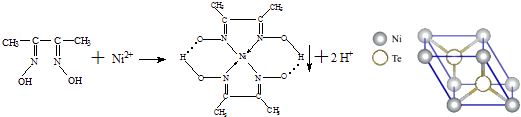
(1)基态Ni2+的核外电子排布式为 .
(2)丁二酮肟组成元素中C,N,O的电负性由大到小的顺序为 .
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 .
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为﹣19.3℃.Ni(CO)4的晶体类型是 .
(5)人们在研究分子结构时发现,CO与N2分子结构非常相似,我们把具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子体”.请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 .
(6)对于A物质: ①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 , 氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在 .
查看答案和解析>>
科目: 来源: 题型:
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是________,被氧化的元素是_________,氧化剂是_________,还原剂是_________,氧化产物是_________,还原产物是__________。
(2)用双线桥标出电子转移的方向和数目:2KNO3+ 3C+ S ═ K2S + N2↑+ 3CO2↑________。
(3)当0.1molCO2生成时,则转移的电子数为___________个。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( ) 
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32﹣)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com