
科目: 来源: 题型:
【题目】参考如图和有关要求回答问题: 
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图1是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).
(2)以CH3OH燃料电池为电源电解法制取ClO2 . 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂. ①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”、“不变”).负极反应式为 .
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2 . 阳极产生 ClO2的反应式为 .
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为mol.
(3)图2中电解池改为用石墨作电极,在一定条件下电解0.05molL﹣1的硫酸铜溶液200mL,当两极产生的气体体积相同时, ①发生电解的总反应方程式为
②若电解后溶液的体积还是200mL,溶液的pH=
③电解后加入下列固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4 .
查看答案和解析>>
科目: 来源: 题型:
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
已知各物质在不同温度下的溶解度见右表。
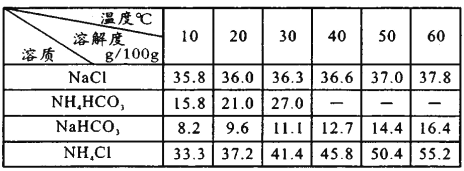
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应A(g)+3B(g)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 molL﹣1min﹣1
B.v(B)=1.2 molL﹣1s﹣1
C.v(D)=0.4 molL﹣1min﹣1
D.v(C)=0.1 molL﹣1s﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2和NOx是主要的大气污染物。某小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制氨气的化学方程式为_________。
②制备和收集纯净、干燥的氨气,可以选择下图装置______(填序号),C中试剂为______。

(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。)
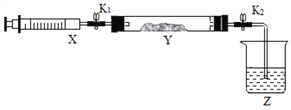
①在硬质玻璃管Y中加入少量催化剂,将NO2气体注入Y管中,Z中应盛装______。
②打开K1,将注射器X中的NH3缓慢注入Y中,发生反应的方程式为_______。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因是_________。
(3)该小组进一步研究SO2的性质,探究SO2能否与Na2O2发生氧化还原反应。实验室用铜丝和浓硫酸反应生成SO2的化学方程式为____________。利用(2)中装置,将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中淡黄色粉末变成白色。设计方案检验生成的白色物质中含有SO42-_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,发生如下反应:3A+B2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(Ls),则10s后容器中的B的物质的量是( )
A.2.8 mol
B.1.6 mol
C.3.2 mol
D.3.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示: 
(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点(横纵坐标都是10﹣6 , )则此时水的离子积从变到 , 造成水的离子积变化的原因是 .
(2)已知25℃时,0.1L 0.1molL﹣1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
(5)常温25℃时pH=2的硫酸升高到100℃时pH=常温25℃时pH=12NaOH升高到100℃时pH= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com