
科目: 来源: 题型:
【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸( 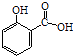 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时: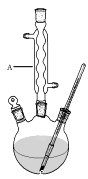
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 , 加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(2)制备水杨酸甲酯时,最合适的加热方法是。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是。
(4)反应结束后,分离出甲醇采用的方法是。
(5)实验中加入无水硫酸镁的作用是。本实验的产率为(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4CO(g)+2NO2(g)N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
A.v(CO)=1.2 mol/(Ls)
B.v(NO2)=0.3 mol/(Lmin)
C.v(N2)=0.6 mol/(Lmin)
D.v(CO2)=1.2 mol/(Lmin)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
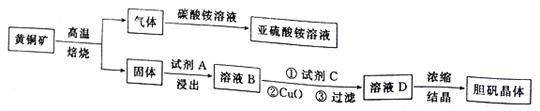
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
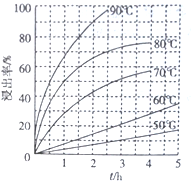
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为 . 若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和溴蒸气发生取代反应,其一溴取代物只有一种,则此烃结构简式为 , 名称是 . 若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2﹣二甲基丁烷,则此烃结构简式为 , 名称是 , 与溴发生加成反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质的说法正确的是
A.硫酸钠溶液能导电,所以它是电解质B.电解质在熔融状态下都能导电
C.水溶液能导电的化合物不一定是电解质D.难溶物质肯定不是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期元素.B、E同主族,且满足最高正化合价+最低负化合价=0;A与C、D与C之间都能形成原子个数比分别为2:1和1:1的两种化合物.试解答下列有关问题.
(1)在A2C 2分子中含有的化学键是______和______.
(2)C与D形成的化合物的电子式为______.
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为______.
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式______.
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某有机物A的结构,进行如下实验. [分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成9.0g H2O和17.6g CO2 , 消耗氧气13.44L(标准状况下).则该物质的最简式是 , 能否据此确定该有机物的分子式(若能则写出其分子式,若不能请说明理由)
(2)根据价键理论,预测A可能的结构种(不考虑立体异构).
(3)[结构式的确定] 经测定,有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出气体,则A的结构简式为 .
(4)[性质实验] A在一定条件下脱水可生成B,B可发生加聚反应生成C,请写出A转化为B的化学反应方程式: .
(5)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请选用B的某同系物和其他试剂及合适的方法制备氯乙烷,要求原子利用率为100%,写出制备反应方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是___,该物质中化学键类型是_____,电子式是__________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为______,化学键类型为_____(填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____________,其化学键类型为__________;加热时生成__________,其化学键类型为________,电子式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com