
科目: 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;G的名称______。
(2)B的结构简式_______;H的结构简式____________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)E→F的化学方程式:_____________。
(6)F→G的化学方程式:_____________。
(7)写出G的同分异构体中与CH3COOH互为同系物的结构简式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分类法是学习和研究化学物质的一种常用科学方法。下列“链状连环”图案中,相连的两种物质均可归属为一类,相交部分A、B、C、D为其分类依据代号。请回答:

(1)请将A、B、C、D填入相应的括号内。
( )两种物质都是氧化物
( )两种物质都是盐
( )两种物质都不是电解质
(2)用洁净的烧杯取25mL蒸馏水,加热至沸腾,逐滴加入上图中一种物质的饱和溶液5~6滴,继续加热,制得红褐色的胶体。
①以上反应的化学方程式为 。
②简述胶体制取成功的判断依据是 。
③向该胶体中逐滴加入稀硫酸,观察到:
A.先出现红褐色沉淀,说明胶体发生 。
B.随后红褐色沉淀溶解,反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯环上原有取代基对新导入取代基所占的位置有一定影响,其规律是:(1)苯环上新导入的取代基所占的位置主要取决于原有取代基的性质。(2)把原有取代基分成两类:一类取代基主要使新导入的取代基进入苯环的邻位和对位,如-CH3(或烃基)、—Br等;另类取代基主要使新导入的取代基进入苯环的间位,如—NO2、—CHO等。
已知:苯在FeBr3粉存在的条件下与液溴发生取代反应:
![]()

请回答下列问题:
(1)写出A、B、C的结构简式:A_______,B_______,C_______。
(2)写出下列转化的化学方程式,并指明反应类型。
① ________________,______;②________________,______;③________________,______;
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe2+、Fe3+与O22﹣、CN﹣、F﹣、有机分子等形成的化合物具有广泛的应用. 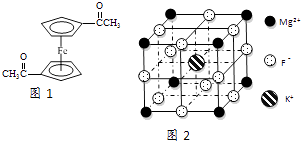
(1)C、N、O原子的第一电离能由大到小的顺序是
(2)Fe2+基态核外电子排布式为 .
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示.此物质中碳原子的杂化方式是 .
(4)配合物K3Fe(CN)6可用于电子传感器的制作.与配体互为等电子体的一种分子的化学式为 . 已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为 .
(5)F﹣不仅可与Fe3+形成[FeF6]3﹣ , 还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示.该晶体的化学式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( ) 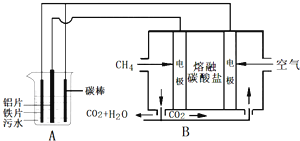
A.装置A中碳棒为阴极
B.装置B中通入空气的电极反应是O2+2H2O+4e-═4OH-
C.污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果
D.标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是( )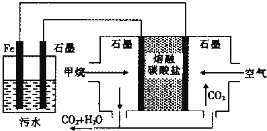
A.铁电极的电极反应式为:Fe-2e-═Fe2+
B.通人空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO![]()
C.若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5mol
D.为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2 , 将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2N2O4;△H<0) 
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VAVB . (填“>”、“<”、“=”);若打开活塞K2 , 气球B将(填:变大、变小、不变).
(2)若在A、B中再充入与初始量相等的NO2 , 则达到平衡时,NO2的转化率αA将(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 , B中NO2的转化率将(填:变大、变小、不变).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深.
(4)若在容器A中充入4.6g的NO2 , 达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: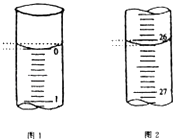
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
(1)F原子基态的外围核外电子排布式为 .
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点(高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com