
科目: 来源: 题型:
【题目】为除去MgCl2酸性溶液中的Fe3+ , 可在加热搅拌的条件下,加入一种试剂,过滤后再加入适量盐酸,这试剂不可以是( )
A.NH3H2O
B.MgO
C.Mg(OH)2
D.MgCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】我国在基本解决温饱之后,存在着碘、铁、钙、维生素A等比较普遍的微量营养素缺乏,食物强化是我国营养改善策略的重要组成内容。下列物质中,最适合用于铁强化的是( )
A.酱油B.食盐C.牛奶D.奶粉
查看答案和解析>>
科目: 来源: 题型:
【题目】某种胶体在电泳时,它的胶粒向阳极移动。在这胶体中分别加入下列物质:①乙醇溶液、②氯化钠溶液、③土壤、④氢氧化铁胶体,不会发生聚沉的是
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。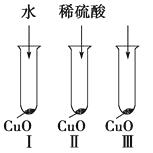
(1)该同学提出的假设是。
(2)通过实验Ⅰ可以证明。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认实验为:在Ⅲ中先加入溶液,再加入溶液。
(4)探究结果为。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
查看答案和解析>>
科目: 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: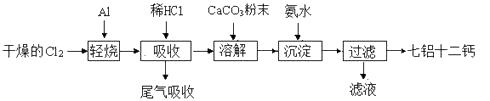
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: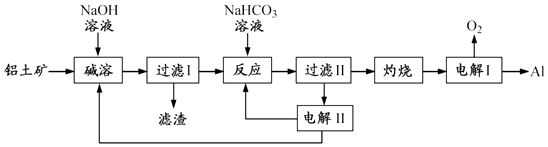
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
(1)“碱溶”时生成偏铝酸钠的离子方程式为 .
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).
(3)“电解Ⅰ”是电解熔融 Al2O3 , 电解过程中作阳极的石墨易消耗,原因是 .
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.
阳极的电极反应式为 , 阴极产生的物质A的化学式为 .
(5)铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。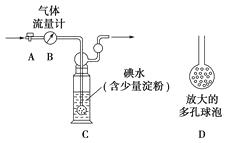
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是:。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种?
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量(填“偏高”、“偏低”或“无影响”)。
(4)写出步骤②中反应的化学方程式。
(5)步骤③中洗涤沉淀的方法是。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物.随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要.图是含铬工业废水和含氰废水的处理流程: 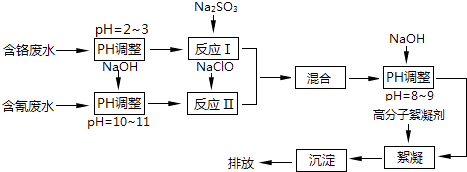
请回答下列问题:
(1)电镀废水中的铬主要以CrO42﹣形式存在,其中Cr元素的化合价为 .
(2)酸性条件下,CrO42﹣极易被还原剂还原为毒性较小的Cr3+ . 图中“反应Ⅰ”的离子方程式为 .
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN﹣)氧化为无毒的两种物质,这两种物质是、(写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 .
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 .
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理. ①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是 .
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为 , 当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。

请按要求回答下列问题:
(1)写出烧瓶中发生反应的离子方程式_______________________________。
(2)①装置B中盛放的试剂名称是____________,作用是___________,现象是______________;
②装置D和E出现的不同现象说明的问题是__________________________________;
③写出G中发生反应的离子方程式____________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置
___________之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为_______(填字母序号)
a. 湿润的碘化钾淀粉试纸 b. 浓硫酸
c. 湿润的红色布条 d. 饱和食盐水
(4)A装置中分液漏斗内所用溶液浓度为12 mol/L,现欲用其配制100 mL 2 mol/L的稀溶液。则需量取________ mL浓溶液,量取所用量筒的规格是________(选填“10mL”、“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是__________
a. 配制前,容量瓶中有少量蒸馏水 b. 量取浓溶液时,仰视液面
c. 未经冷却,立即转移至容量瓶定容 d. 定容时,仰视液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com