
科目: 来源: 题型:
【题目】某同学在家自制“84消毒液”,他根据84消毒液标签上的配方,用NaC1O固体配制480mL质量分数为25%的、密度为1.19g/cm3的NaC1O消毒液.下列说法正确的是( )
A.容量瓶用蒸馏水洗净后需晾干才能使用
B.需称取NaClO固体144g
C.所配得NaClO消毒液久置后会失效
D.8 4消毒液的消毒原理是利用了NaClO的强碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅣA族的碳、硅等元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)在基态14C 原子中,核外存在__________对自旋相反的电子;CO32- 离子的几何构型为__________。
(2)利用反应Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl 可检验乙炔。乙炔分子中σ键与π键数目之比为__________,NH4Cl 中含有的化学键类型有__________。
(3)“分子机器设计和合成”的研究对象之一为“分子开关”,“分子开关”与大环主体分子苯芳烃、杯芳烃等有关。
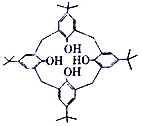
①右图为对叔丁基杯[4]芳烃,由4 个羟基构成杯底,羟基间的相互作用力是__________。对叔丁基杯[4]芳烃中碳原子的杂化方式有__________。
②杯芳烃可用于某些ⅢB族元素金属离子如57La3+及21Se2+ 的萃取,基态Se2+核外电子排布式为__________。
(4)硅、硒均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se__________(填“>”或“<”)Si。
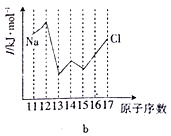
与Si同周期的部分元素的电离能(I)如图所示,其中代表第二电离能的图是__________(填标号)。


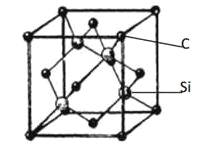
(5)金刚砂(SiC)的晶胞结构如下图所示,每个C原子周围距离最近的C原子数目为__________个;若晶胞的边长为a pm,则金刚砂的密度表达式为__________g · cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)?
(3)方案三中的“冷却”应如何操作:;
理由是。
(4)方案四中计算碳酸钙纯度的公式为;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案:。
方案:。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,如下措施中①向盐酸中加少量水;②将铁粉换成铁片;③升高温度:④将盐酸换成与之等体积等浓度的硫酸,能达到目的有( )
A.②④B.①②C.②③D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl﹣)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)═2c(HCO3﹣)+2c(H2CO3)+2c(CO ![]() )
)
D.pH=1的NaHSO4溶液:c(H+)═2c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
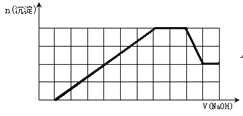
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C. 原溶液中一定含有SO42-和Na+
D. 反应最后形成的溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述不正确的是( )
A.标准状况下,22.4 L的CCl4中所含质子数为74 NA
B.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
C.12 g石墨晶体中含有的碳碳键数目为1.5 NA
D.分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com