
科目: 来源: 题型:
【题目】1,6-己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F).回答问题: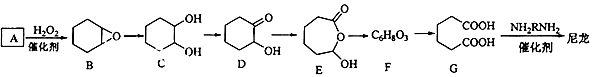
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为;
(2)B到C的反应类型为;
(3)F的结构简式为;
(4)在上述中间物质中,核磁共振氢谱中峰最多的是 , 最少的是(填化合物代号,可能有多选)。
(5)由G合成尼龙的化学方程式为;
(6)由A通过两步制备1,3﹣环己二烯的合成线路为(样式:A条件和试剂B一定条件 C)。
(7)有机物C的同分异构体属于酯类的有种.
查看答案和解析>>
科目: 来源: 题型:
【题目】软锰矿的主要成分为MnO2 , 含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。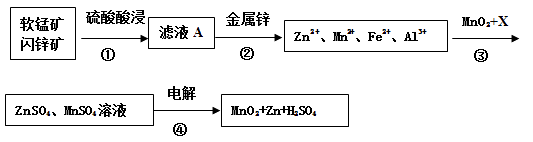
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是。
(3)步骤③中MnO2的作用是 ,另外一种物质X可以是 。
A.ZnO B.MgCO3 C. MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2 , 它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式。
(5)已知:HCN的电离常数K=4.9×10-10 , H2S的电离常数K1=1.3×10―7 , K2=7.0×10―15 , 向NaCN溶液中通入少量的H2S气体,反应的离子方程式为。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中E为量气装置。
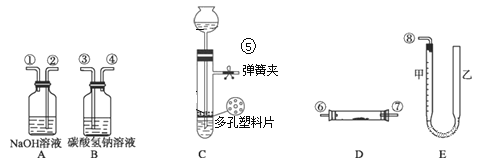
本实验可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、大理石、水。
试回答:
(1)图中装置的连接顺序是(填装置的字母编号),其中连接胶管及支持装置省略:_________。
(2)装置C中放入的反应物是________和_________________。(写化学式)
(3)装置A的作用是__________________;装置B的作用是_______________。
(4)装置D中发生的化学反应方程式为__________________________。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意_____________。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,有以下物质相互转化,其中B溶液为浅绿色,I溶液为棕黄色,J为AgCl,请回答:

(1)C是(填化学式)_____,F的化学式_____.
(2)写出B的化学式______,检验B中阳离子的操作方法是__________________.(只填一种方法,用文字表述)
(3)写出由G转变成H的化学方程式_______________________.
(4)写出检验I溶液中阳离子的离子方程式________________;向I溶液中加入单质Cu的有关离子反应方程式是______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol·L-1、0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液。
②样品处理:![]()
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
(1)配制100 mL 0.01 mol·L-1溶液,需要的玻璃仪器有:烧杯、玻璃棒,还需要:、。
(2)步骤②脱色过程包括加入:(填脱有机色素的吸附剂名称)→搅拌煮沸→冷却→(填操作)。
(3)比色法确定待测液的浓度的原理是。
(4)若其补铁剂是由乳酸[CH3CH(OH)COOH]与铁粉作用生成的,请写出该反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是

A. Cu和浓硝酸 B. CaO和浓氮水 C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】人的血液里Ca2+的浓度一般采用g·cm-3表示,今抽一血样20.00 mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀冼净后溶于强酸可得草酸,再用浓度为0.02 mol·L-1的KMnO4溶液滴定。当观察到溶液紫色褪尽时,共消耗12.00 mL KMnO4溶液。则该血液样品中Ca2+的浓度为( )
A.0.0015 g·cm-3
B.0.0012 g·cm-3
C.0.0024 g·cm-3
D.0.002 g·cm-3
查看答案和解析>>
科目: 来源: 题型:
【题目】金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子[M(CN)n]m-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
终点时,溶液由黄色变成橙红色。Ag++2CN-=[Ag(CN)2]-
根据以上知识回答下列问题:
(1)水样预处理的目的是。
(2)水样预处理的装置如图,细导管插入吸收液中是为了。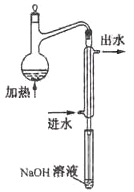
(3)蒸馏瓶比吸收液面要高出很多,其目的是。
(4)如果用盐酸代替磷酸进行预处理,实验结果将(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为mg·L-1(以CN-计,计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
滴定次数 | 用去NaOH溶液的体积 | ||
滴定前刻度 | 滴定后刻度 | 体积(mL) | |
1 | 3.20 | 22.48 | |
2 | 1.23 | 20.55 | |
3 | — | — | |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是()
A.酸式滴定管
B.烧杯
C.100 mL容量瓶
D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用。
(4)滴定操作时,左手应 , 观察滴定管里液面的高度时应注意。
(5)选用的合适指示剂是 , 变色情况是。
(6)计算稀释后容量瓶中醋酸的物质的量浓度。
(7)计算“老谢琼醋”中醋酸的质量分数。
查看答案和解析>>
科目: 来源: 题型:
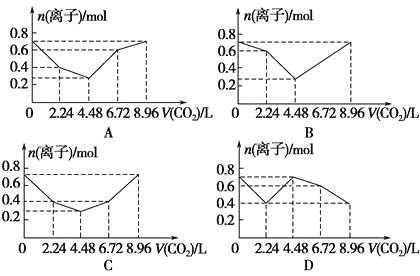
【题目】向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com