
科目: 来源: 题型:
【题目】下列有机物命名正确的是( )
A.2,4,5﹣三甲基﹣5﹣乙基辛烷
B.2,5﹣二甲基﹣4﹣乙基己烷
C.3﹣甲基﹣4﹣乙基戊烷
D.2,3﹣二甲基﹣4﹣戊烯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、冰水混合物
C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热、过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀硫酸中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
(1)步骤三中称取的(NH4)2SO4质量为。
(2)①铁屑用Na2CO3溶液处理的目的是。
制备FeSO4溶液时,用右图装置趁热过滤,原因是。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀盐酸外,还应注意的问题是。
④该实验最终通过确定硫酸亚铁铵产品等级。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO![]()
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液
A. ①③④⑤ B. ①③④⑥ C. ①③④⑤⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5%KSCN溶液、pH=4的HAc-NaAC缓冲溶液、1∶1HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 ml容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
Ⅰ.配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL5%KSCN溶液和2.5 mLpH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
Ⅱ.制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL1∶1 HNO3溶液,小心加热2~3 min。冷却后,全部移入100 mL容量瓶中,再加入4.0 mL5%KSCN溶液和10.0 mLpH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL待测液加入与Ⅰ中相同规格的比色管中。
Ⅲ.比色:将Ⅱ所得比色管中的溶液与Ⅰ中各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显色。
(2)完成该实验,还缺少的仪器有、。
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是?
(4)实验中量取HNO3溶液、HAc-NaAc缓冲溶液用量筒即可,原因是?
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是?
(6)若测得待测液中Fe3+的物质的量浓度为c mol/L,药片的质量为m , 则药片中铁元素的质量分数为?
查看答案和解析>>
科目: 来源: 题型:
【题目】水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2 , 溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B.
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
c.检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
(1)比色法的基本依据是;
(2)若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为mg/L.
(3)用NaNO2直接配制溶液B的缺点是 .
(4)如果水样显色后比6号还深,应采取的措施是
查看答案和解析>>
科目: 来源: 题型:
【题目】下列液体中,不会出现丁达尔现象的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液 ⑤Fe(OH)3胶体 ⑥肥皂水.
A.②④B.③④C.②④⑥D.④
查看答案和解析>>
科目: 来源: 题型:
【题目】物质中铁含量的测定方法是多种多样的.
土壤中铁含量的测定是先将Fe3+还原为Fe2+ , 然后使Fe3+与邻啡罗( 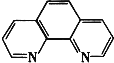 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
(1)基态Fe2+的核外电子排布式为。
(2)羟胺(NH2OH)中氮.氧原子的杂化方式是。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应不可能发生的是
A. Cu+2Fe3+==Cu2++2Fe2+ B. 10Cl-+2MnO![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
C. Cu+Cl2![]() CuCl2 D. 5Pb2++2MnO
CuCl2 D. 5Pb2++2MnO![]() +2H2O=5PbO2↓+2Mn2++4H+
+2H2O=5PbO2↓+2Mn2++4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A与盐酸反应生成B和氢气,D为单质。根据上图回答下列问题:

(1)C的化学式为_______;B+D→C的化学方程式为______________。
(2)B与氨水反应的现象为___________________________________,请写出该现象的离子方程式______________;_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com