
科目: 来源: 题型:
【题目】工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 ![]() 铁屑
铁屑![]() 溶液(留有少量铁屑)
溶液(留有少量铁屑)![]() 滤液
滤液 ![]() 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是。
(2)步骤②中烧杯底部留有少量铁屑的理由是。
说明剩余铁屑作用的离子方程式为。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是;。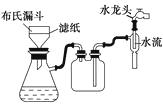
(4)检查步骤③的滤液中没有Fe3+的方法是。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。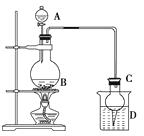
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: 。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);
反应结束后D中的现象是。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 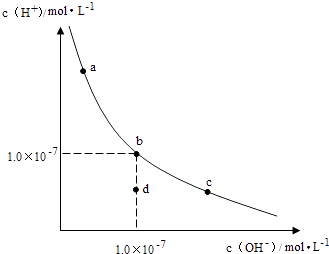
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,在0.1molL﹣1的HNO3溶液中,由水电离出的c(H+)< ![]()
B.浓度为0.1molL﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣)
C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是
A. NaHCO3= Na++ H++CO32- B. Ba(OH)2=Ba2++OH-
C. H2SO4=H2++SO42- D. Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是;
简述混合液体时最后加入浓硫酸的理由:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。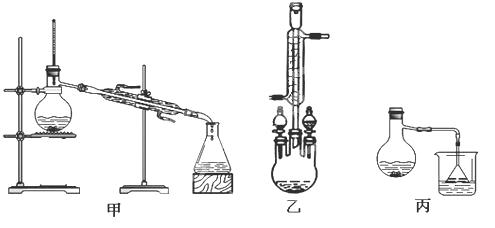
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ。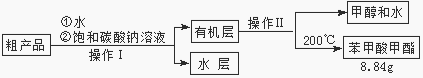
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),
并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是( )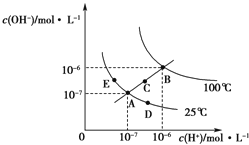
A.图中五点KW间的关系:B=C=A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性
查看答案和解析>>
科目: 来源: 题型:
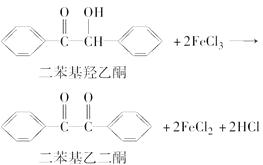
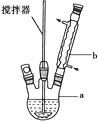
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下: 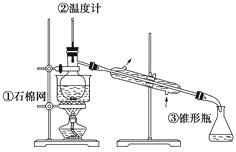
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:
a , b。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用、等方法促进晶体析出。
(3)抽滤所用的滤纸应略(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯
基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是。
A.无水乙醇 B.饱和氯化钠溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________。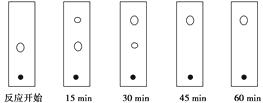
A.15 min
B.30 min
C.45 min
D.60 min
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4L氯气溶于水形成饱和溶液,发生反应过程转移电子数目为NA
B. 标准状况下,22.4LNO与11.2LO2混合后气体中分子总数等于NA
C. 将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下0.1 molOH—含NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com