
科目: 来源: 题型:
【题目】(1)一定温度下,向1L 0.1molL﹣1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中![]() 的值 (填“增大”、“减小”或“不变”).
的值 (填“增大”、“减小”或“不变”).
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O.已知:
a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10﹣5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式).
(3)99℃时,Kw=1.0×10﹣12 , 该温度下测得0.1molL﹣1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为 .
②该温度下,将0.01molL﹣1 H2A溶液稀释到20倍后,溶液的pH= .
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 .
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1molL﹣1 H2A溶液与0.2molL﹣1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 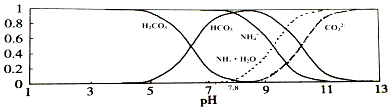
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
请回答下列问题:
(1)下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是 , 集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是 , 其作用是。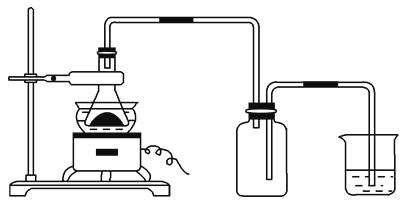
(2)下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞 , 关闭活塞 , 从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞 , 打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。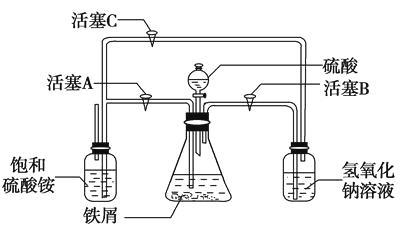
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级~Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol/LNaOH溶液的含义是( )
A.1L溶液中含有40gNaOHB.1L水中含有1molNaOH
C.溶液中含有1molNaOHD.将40gNaOH溶于1L水中所得的溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。(巳知PdCl2能被CO还原得到黑色的Pd)
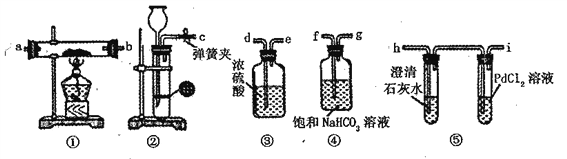
(1)请将上图各装置连接完整(填写装置中字母):c→ f→ g→_____ →______→a →b →h。
(2)若用稀盐酸与CaCO3反应制备CO2在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是_________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到__________________时再点燃酒精灯。
(4)若反应过程中CO2足量,探究钠与CO2充分反应后生成物可能的情况,某同学认为生成的物质仅为Na2CO3固体,老师认为仅生成Na2CO3是不可能的,请你说出不可能的理由_______。
(5)假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
I.装置⑤PdCl2溶液中观到有黑色沉淀装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体:_________________________________。
Ⅱ装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量盐酸中产生224mL标准状况)CO2气体,且溶液中还有固体残留_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】晶体硅是信息科学和能源料学的一种重要材料,可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法:
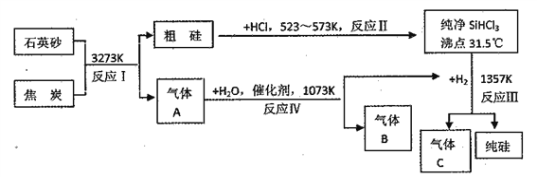
请回答下列问题
(1)反应I的化学方程式为______________________;在上述生产过程中除反应I属于置换反应的有________________________(填反应的代号“I→IV")。
(2)A、B、C三种气体,在“节能减排”中作减排目标的一种气体是________。(写化学式)
(3)纯硅可与强碱反应放出氢气,其化学方程式为_______________________________。
(4)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,则工业上制得纯净H2的化学方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据《天工开物》记载我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法不正确的是
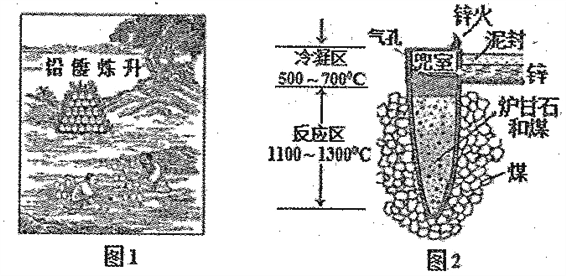
A. 升炼佞铅过程包含氧化还原反应
B. “锌火”是锌蒸气和-氧化碳在空气的燃烧
C. “泥封”的目的是为了防止得到的锌被氧化
D. 冶炼时锌变为蒸气在兜室冷凝为固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是 ( )
A.K+ H+ SO42- OH-B.Na+ CO32﹣ Ca2+ NO3-
C.Na+ H+ Cl- CO32﹣D.Na+ Cl- SO42- H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com