
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,KI+3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
方法3:I2![]() HIO3
HIO3![]() KIO3
KIO3
(1)与方法3相比方法1的不足是 ,
方法2的不足是。
(2)方法2选用的电极是惰性电极,则其阳极反应式是?
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是?
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】四个化学小组的同学测定某Na2CO3固体样品(仅含NaCl杂质)的纯度,他们提出了各自的气体分析法。
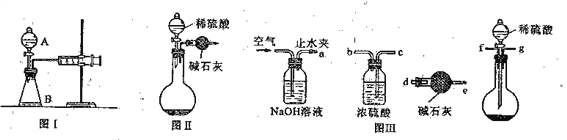
(1)第一小组用图I所示装置,仪器A的名称_____________。把m1g的混合物与足量稀硫酸反应后,测定产生CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是__________________________________________________________________________。
(2)第二小组用图装置测定CO2的质量。该装置存在明显缺陷是:__________________。
(3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的仪器如图Ⅲ,装置的连接顺序是a→____________________________________。(填写接口字母,图中仪器可重复使用)。实验中取了样品m1g,称量干燥管质量为m2g;与足量稀硫酸反应后称量干燥管质量为m3g,则Na2CO3的纯度表达式为__________________。
(4)第四小组设计用沉淀法来测定。方案是滴加沉淀剂使碳酸钠转化为沉淀,然后过滤、洗涤、干燥后称量沉淀质量。经讨论认为需要用Ba(OH)2液代替澄清石灰水Ca(OH)2来做沉淀剂其原因__________________(填入正确选项)。
a. Ba(OH)2比Ca(OH)2便宜
b. Ba(OH)2溶解度大于Ca(OH)2,可以增大Ba(OH)2浓度,无需加入过大体积的沉淀剂
c.相同条件下,CaCO3的溶解度明显小于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
查看答案和解析>>
科目: 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程要分三步,完成下列填空。
(1)步骤一、灼烧干海带,使其灰化后用热水浸泡过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在___________(填写仪器名称)。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I—,制得富碘溶液。通适量氯气发生反应的离子方程式为___________________________。
(3)步骤三:取l00mL步骤二中富碘溶液,按如下流程分离碘单质。

酸化过程发生的反应是:5I—+IO3—+6H+=3I2+3H2O,则萃取Ⅱ发生的反应离子方程式为_________________________________________________________________________。
萃取剂X应选择____________________(选填編号)。
a.100mL苯 b.10mL乙醇 c.10mLCCl4
操作I的名称是______________________________。
(4)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于XOH型化合物而言,X是除H、O以外的其他元素时,下列说法中正确的是( )
A.XOH的水溶液不能导电B.当X是金属性很强的元素时,XOH一定是强碱
C.XOH一定是离子化合物D.XOH一定是共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000molL﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.00 |
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是 .
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL.![]()
请计算待测烧碱溶液的浓度:mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目: 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: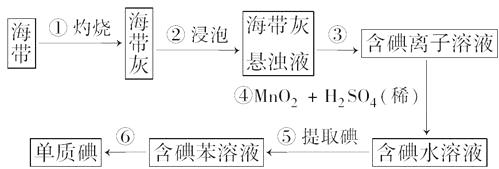
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器是()。(从下列仪器中选择所需的仪器,用标号字母填写在空白处)
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是。
(3)步骤④反应的离子方程式是。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是?
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com