
科目: 来源: 题型:
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 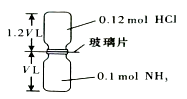
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液含有的氯离子物质的量浓度最大的是( )
A.2mL0.2mol/LNaCl溶液B.1mL0.2mol/LKCl溶液
C.1mL0.2mol/LCaCl2溶液D.1mL0.1mol/LAlCl3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定微粒的数目相等的是( )
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温、同压同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
查看答案和解析>>
科目: 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1molL﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为molL﹣1 , 滴定前将白醋稀释(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至即为终点.重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c molL﹣1).
(6)原白醋中醋酸的物质的量浓度=molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛. 
(1)为了减缓海水对钢闸门A和C的腐蚀,图1中,材料B可以选择(填字母序号). a.锌板 b.铜板 c.碳棒
图2中,钢闸门C作极.若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极
反应式为 , 检测该电极反应产物的试剂是 .
(2)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示(质子交换膜只允许H+自由通过).该电池的正极反应式为 .
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸(弱酸)的原理如图4所示(图中“HA”表示乳酸 分子,A﹣表示乳酸根离子).
①阳极的电极反应式为 .
②简述浓缩室中得到浓乳酸的原理: .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色. 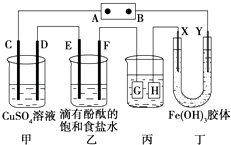
请回答:
(1)B极是电源的 , 一段时间后,甲中溶液颜色 , 丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 , 在电场作用下向Y极移动.
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(3)现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是溶液.当乙中溶液的c(OH﹣)=0.1molL﹣1时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 , 甲中溶液的pH(填“变大”“变小”或“不变”).
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.醋酸与氨水反应:CH3COOH+NH3?H2O═CH3COO﹣+NH4++H2O
B.氯气跟水反应:Cl2+H2O═2H++Cl﹣+ClO﹣
C.钠跟水反应:Na+2H2O═Na++2OH﹣+H2↑
D.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
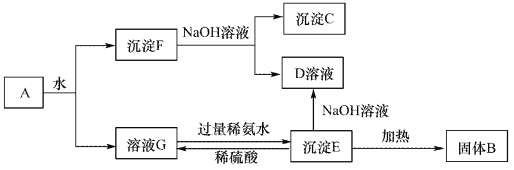
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
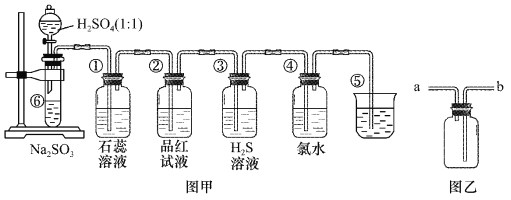
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B. 配制100mL0.10molL﹣1NaCl溶液
配制100mL0.10molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25gNaOH
称量25gNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com