
科目: 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl+ClO
2H+ + Cl+ClO
B. AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+
C. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
D. 向FeCl3溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( ) 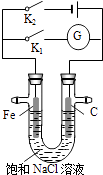
A.K1闭合,铁棒上发生的反应为2H++2e﹣═H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体
查看答案和解析>>
科目: 来源: 题型:
【题目】近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示:
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
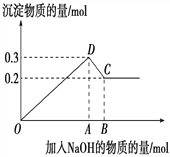
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 体积为44.8L B. 电子数为32×6.02×1023
C. 质量为88g D. 含有4mol原子
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室在常温下将浓盐酸与高锰酸钾混合能够制氣气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O下列有关该反应的说法正确的是( )
A.KMnO4是还原剂
B.HCl是氧化剂
C.HCl中的氯元素得到电子
D.KMnO4中的Mn元素被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于溶液中离子的说法不正确的是( )
A.0.1mol?L﹣1的Na2CO3溶液中粒子浓度关系:c(Na+)═2c(CO ![]() )+2c(HCO
)+2c(HCO ![]() )+2c(H2CO3)
)+2c(H2CO3)
B.常温下,氢氧化钠溶液中滴入醋酸使溶液的pH=7,则混合溶液中醋酸已过量
C.0.2mol?L﹣1的HCl和0.1 mol?L﹣1的NH3?H2O等体积混合后溶液中的离子浓度关系:c(Cl﹣)>c (NH ![]() )>c(H+)>c (OH﹣)
)>c(H+)>c (OH﹣)
D.0.1mol?L﹣1的NaHS溶液中离子浓度关系:c(S2﹣)+c(OH﹣)═c(H+)+c(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.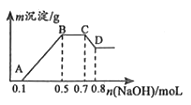
则:
(1)溶液中一定含有的阳离子有 , 一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为molL﹣1和molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:

(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com